9月17日�����,君實生物發(fā)布公告����,該公司就建議A股于科創(chuàng)板上市通過上海證監(jiān)局輔導(dǎo)驗收���。根據(jù)中金公司關(guān)于上海君實生物醫(yī)藥科技股份有限公司輔導(dǎo)工作總結(jié)報告�����,截至目前�,輔導(dǎo)工作已取得良好效果�����,達(dá)到了輔導(dǎo)計劃的目標(biāo)要求�����。去年底,君實生物已在2018年底成功在香港聯(lián)合交易所主板上市�����,成為中國大陸首家“新三板+H”掛牌落地的生物醫(yī)藥企業(yè)���。若進(jìn)展順利��,該公司有望成為中國首家“新三板+H+科創(chuàng)板”的生物醫(yī)藥公司�。同日�����,君實生物還宣布���,PD-1抗體新藥特瑞普利單抗(商品名:拓益)單藥治療經(jīng)標(biāo)準(zhǔn)治療失敗后的晚期局部進(jìn)展或轉(zhuǎn)移性膀胱尿路上皮癌患者的關(guān)鍵注冊臨床研究(POLARIS-03研究)完成最后一例患者入組���。這是一項2期、開放標(biāo)簽���、多中心��、注冊臨床研究���。

早在今年5月��,君實生物已在股東周年大會上����,獲批準(zhǔn)擬發(fā)行不超過8713萬股的該公司A股以及向上海證券交易所申請A股在上海證券交易所科創(chuàng)板上市并準(zhǔn)許買賣及相關(guān)事宜��。
根據(jù)君實生物公布的2019年上半年業(yè)績公告�����,截至2019年6月30日�,該公司實現(xiàn)銷售收入總額3.09億元�。其中,核心產(chǎn)品拓益實現(xiàn)銷售收入3.08億元��;銷售及分銷開支1.11億元�;研發(fā)開支3.69億元,同比增加69%�。
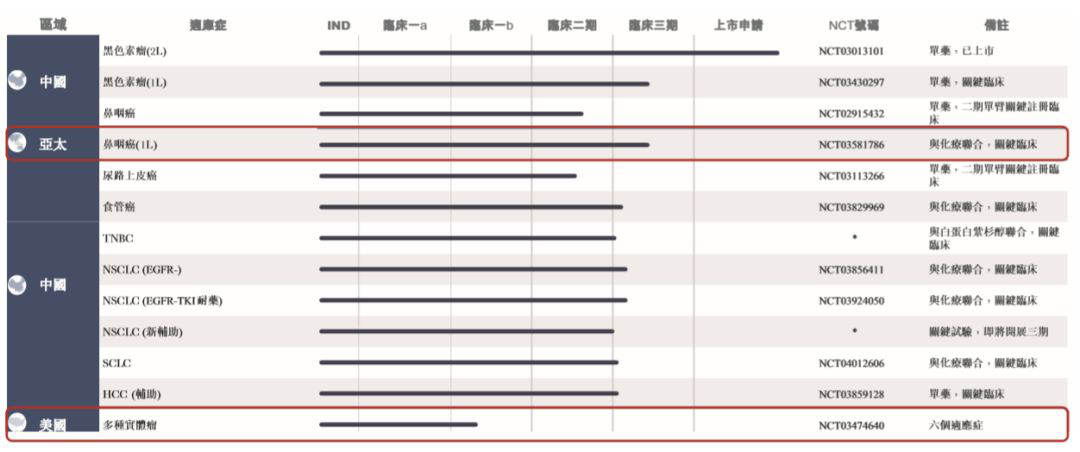
拓益(特瑞普利單抗)在今年2月底實現(xiàn)全國銷售,報告期內(nèi)�����,拓益銷售收入占全部收入99.69%,達(dá)到3.08億��。與此同時�,君實生物仍在繼續(xù)驗證該藥在治療不同瘤種方面的安全有效性,擴(kuò)大受益患者人群�����。截至6月30日�,該公司已開展11項臨床試驗(2期或3期)�,包括鼻咽癌���、尿路上皮癌����、黑色素瘤�、非小細(xì)胞肺癌���、三陰性乳腺癌����、食管癌及肝細(xì)胞癌等��。事實上,君實生物構(gòu)建了豐富的產(chǎn)品管線���,覆蓋了腫瘤免疫�、自身免疫��、神經(jīng)性疾病���、代謝、炎癥等多個領(lǐng)域。共有19個在研產(chǎn)品���,包括13款自主研發(fā)的原創(chuàng)新藥和6款合作開發(fā)新藥。其中��,8款產(chǎn)品已在中國獲得臨床試驗批準(zhǔn)�。根據(jù)公告����,該公司將加快藥物研發(fā)及藥品商業(yè)化�,包括JS001(特瑞普利單抗)在多腫瘤適應(yīng)癥方面的中國試驗及JS001在美國及其他國家的多中心臨床試驗,重點在于首創(chuàng)藥的IND申請及臨床試驗����。
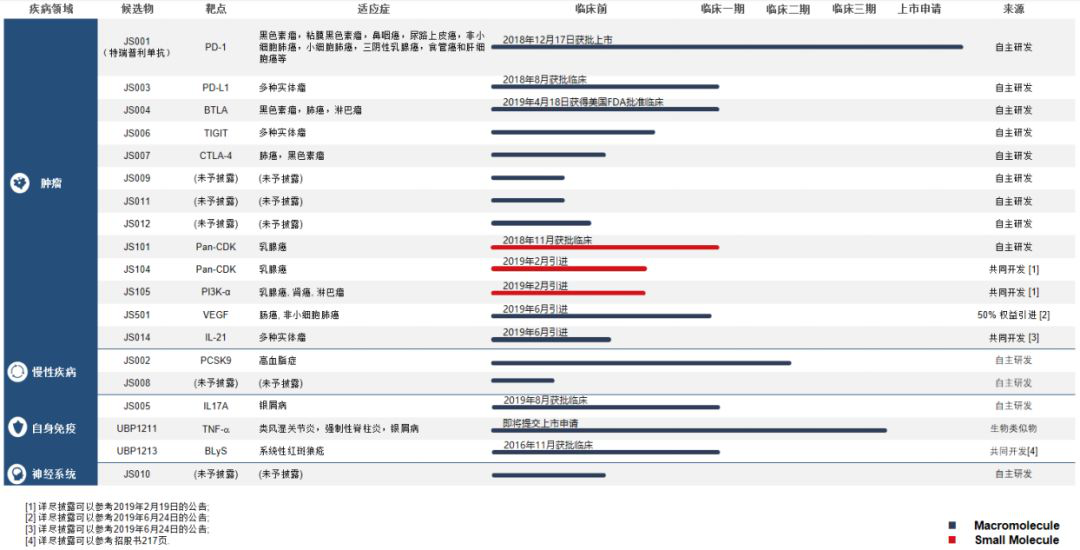
UBP1211:TNF-α靶點單抗藥物�����,君實生物首款生物類似藥��,即將在中國提交NDA。
JS002:在中國獲批臨床的抗PCSK9單克隆抗體,目前正在高脂血癥患者中進(jìn)行2期臨床試驗���,同時在更廣泛的患者群體中進(jìn)行3期臨床研究的準(zhǔn)備工作已啟動�����。
JS004/TAB004:抗BTLA阻斷抗體����,擬用于治療晚期不可切除或轉(zhuǎn)移性實體瘤。今年4月��,該產(chǎn)品獲得美國FDA臨床試驗批準(zhǔn)�����。
JS005:IL-17A單抗�,具有多效性的細(xì)胞因子����,可用于緩解自身免疫性疾病,如銀屑病��、類風(fēng)濕性關(guān)節(jié)炎、強(qiáng)直性脊柱炎等疾病的癥狀���。目前已在中國獲批臨床���。
此外����,君實生物將繼續(xù)擴(kuò)大產(chǎn)品管線,在小分子領(lǐng)域進(jìn)行新藥靶點的探索及研發(fā)并促進(jìn)與優(yōu)秀的小分子藥品公司的合作��,同時推進(jìn)對適用于大分子藥物的潛在靶點的跟蹤及探索研究�。在生產(chǎn)方面�,該公司計劃進(jìn)一步提高大分子藥物的發(fā)酵產(chǎn)能并尋求更先進(jìn)的生產(chǎn)技術(shù)以降低成本及滿足市場需求��。值得一提的是�����,今年上半年君實生物已投資近4.4億元用于建設(shè)臨港生產(chǎn)基地��,以大幅提升該公司現(xiàn)有產(chǎn)能�。





