日前����,諾華(Novartis)公司宣布���,該公司開(kāi)發(fā)的抗IgE人源化單克隆抗體ligelizumab(QGE031)���,在治療H1-抗組胺藥控制不佳的慢性自發(fā)性蕁麻疹(CSU)患者的2b期試驗(yàn)中,與該公司另一款藥物Xolair(omalizumab)相比��,顯示出更好的療效���,ligelizumab使更多患者的疾病癥狀得到完全緩解�����。
CSU是一種發(fā)作不可預(yù)測(cè)的嚴(yán)重皮膚病�����,癥狀包括皮膚自發(fā)性腫脹和瘙癢����。如果疾病癥狀不能得到有效控制����,則會(huì)對(duì)患者的睡眠,工作效率���,以及生活質(zhì)量產(chǎn)生深遠(yuǎn)的負(fù)面影響�����。最近公布的數(shù)據(jù)表明���,盡管先前接受過(guò)H1/H2-抗組胺蕁麻疹藥物治療,一些CSU患者仍然會(huì)出現(xiàn)無(wú)法控制的癥狀��,對(duì)患者造成極大的疾病負(fù)擔(dān)���。
Ligelizumab是一種作用于IgE(免疫球蛋白E)抗體的單克隆抗體�,現(xiàn)處于治療H1-抗組胺藥控制不佳的CSU患者的臨床開(kāi)發(fā)階段���。Xolair是目前推薦用于治療抗組胺藥控制不佳的CSU患者的唯一療法����。
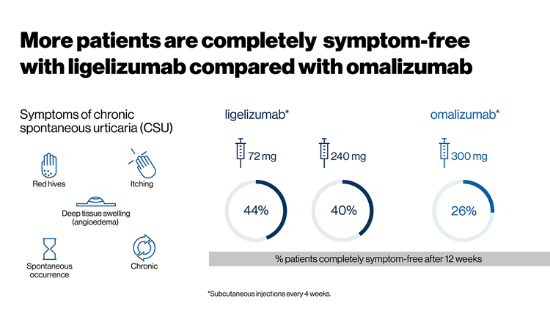
▲Ligelizumab在臨床試驗(yàn)中使患者達(dá)到完全緩解的比例高于Xolair(omalizumab)(圖片來(lái)源:參考資料[1])
在隨機(jī)、雙盲��、含活性對(duì)照的2b期臨床試驗(yàn)中�����,382名H1-抗組胺藥物控制不佳的CSU患者隨機(jī)接受三種不同劑量的ligelizumab或Xolair的治療�。該試驗(yàn)的中期數(shù)據(jù)顯示,在治療的第12周����,接受ligelizumab治療的患者中分別有30%(劑量為24 mg),44%(劑量為72 mg)和40%(劑量為240 mg)患者的疾病癥狀得到了完全緩解�����。而在Xolair治療組中��,這一數(shù)值為26%�。
“目前,約有一半的患者即使接受慢性自發(fā)性蕁麻疹標(biāo)準(zhǔn)療法的治療后�,仍會(huì)出現(xiàn)無(wú)法控制的疾病癥狀����,”諾華公司免疫學(xué)��,肝病學(xué)和皮膚病學(xué)全球研發(fā)負(fù)責(zé)人Eric Hughes博士說(shuō):“我們對(duì)這項(xiàng)研究的積極結(jié)果感到非常的滿意���,期待為患者帶來(lái)更好治療選擇。
參考資料:
[1] Novartis data show more patients are completely symptom-free from chronic spontaneous urticaria with ligelizumab (QGE031) than Xolair? 300 mg, Retrieved October 08, 2019, from https://www.novartis.com/news/media-releases/novartis-data-show-more-patients-are-completely-symptom-free-from-chronic-spontaneous-urticaria-ligelizumab-qge031-xolair-300-mg
[2] Novartis confidently breaks out mid-stage data on Xolair competitor, Retrieved October 08, 2019, from https://endpts.com/novartis-confidently-breaks-out-mid-stage-data-on-xolair-competitor/



