近日�,耶魯大學(xué)陳斯迪教授課題組在《自然》子刊Nature Immunology上發(fā)表研究論文�����,介紹了一種新型的癌癥免疫療法�����。在三陰性乳腺癌�、黑色素瘤和胰腺癌等三種小鼠腫瘤模型中����,這種療法都取得了良好的治療效果。
目前主要的癌癥免疫療法包括免疫檢查點(diǎn)抑制劑療法�����,過繼性細(xì)胞療法�����,重組細(xì)胞因子��,以及癌癥疫苗等��,其基本原理是提高免疫系統(tǒng)對(duì)癌細(xì)胞的識(shí)別和殺傷能力,因而免疫系統(tǒng)對(duì)腫瘤相關(guān)抗原(tumor-associated antigens���,TAAs)的特異性識(shí)別和殺傷能力是決定該類療法成敗的關(guān)鍵�����。然而TAAs可能存在先天自發(fā)性的表達(dá)不足和對(duì)其識(shí)別的不足�,也有可能出現(xiàn)后天習(xí)得的抗原表達(dá)下調(diào)����,甚至完全沉默某些抗原的表達(dá)和呈遞。這些現(xiàn)象加上腫瘤免疫微環(huán)境的進(jìn)一步抑制��,很容易導(dǎo)致免疫逃逸的發(fā)生��。盡管癌癥免疫療法在臨床癌癥治療中取得了巨大的成功�,但僅有一部分患者能從中獲益。我們無疑需要新的思路和方法去提高腫瘤細(xì)胞表面特異性抗原的表達(dá)和呈遞����。

▲本研究的通訊作者陳斯迪教授(圖片來源:耶魯大學(xué)官方頁面截圖)研究人員們?cè)诮袢盏恼撐闹刑岢隽艘环N名為“集成內(nèi)源基因激活免疫療法”(Multiplex Activation of Endogenous Genes as Immunotherapy)的新型癌癥免疫療法�����,縮寫為MAEGI。MAEGI利用“CRISPR激活”(CRISPRa)技術(shù)����,將不具有核酸酶活性的Cas9蛋白與轉(zhuǎn)錄激活因子融合,再由sgRNA引導(dǎo)到靶基因的位置�,來激活多個(gè)指定目標(biāo)基因的表達(dá),借此促進(jìn)潛在內(nèi)源性抗原的表達(dá)����,進(jìn)而達(dá)到提高免疫識(shí)別和免疫清除的目的。研究者們證明了CRISPRa技術(shù)能在細(xì)胞水平上增強(qiáng)靶基因相關(guān)抗原的表達(dá)和呈遞�,進(jìn)而誘導(dǎo)更強(qiáng)的效應(yīng)T細(xì)胞反應(yīng)。此外�����,其誘導(dǎo)的內(nèi)源基因激活還能在小鼠模型中�,讓腫瘤細(xì)胞更容易被機(jī)體免疫系統(tǒng)清除。這為MAEGI的概念奠定了基礎(chǔ)�。
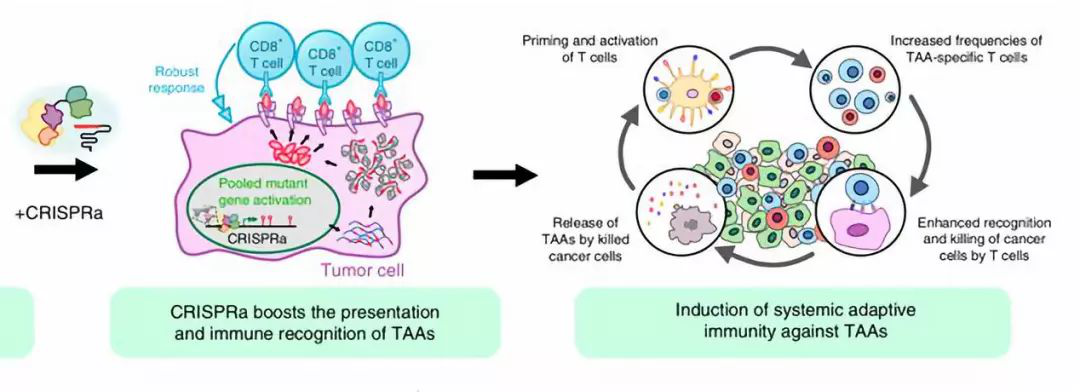
▲CRISPRa能提高TAAs表達(dá)和呈遞,誘導(dǎo)更強(qiáng)的過繼免疫反應(yīng)(圖片來源:參考資料[2])研究者使用了相對(duì)安全的腺相關(guān)病毒(AAV)作為基因載體����,來解決MAEGI療法的遞送,鑒于單個(gè)腫瘤具有與正常組織區(qū)分開的獨(dú)特的基因突變譜,為了實(shí)現(xiàn)精準(zhǔn)治療(p-MAEGI)���,研究人員通過全外顯子測(cè)序����,找出一個(gè)三陰性乳腺癌細(xì)胞系的所有突變基因���,生成了僅靶向腫瘤組織�,涵蓋了1116個(gè)突變基因的3839個(gè)sgRNA文庫(kù)��,以及相應(yīng)的AAV-p-MAEGI庫(kù)���,再通過瘤內(nèi)注射方式來遞送�,并靶向激活所有可以產(chǎn)生腫瘤新抗原的突變基因����。試驗(yàn)顯示,44%的原位瘤產(chǎn)生完全/近完全緩解�,67%的非直接注射的同體非原位瘤也產(chǎn)生了完全緩解。值得一提的是���,p-MAEGI療法治愈的小鼠三個(gè)月后仍然可以完全清除同種腫瘤的攻擊�����,并保持了6個(gè)月以上的完全緩解����,表明p-MAEGI產(chǎn)生免疫反應(yīng)的全身性���,長(zhǎng)效性和持久性��。
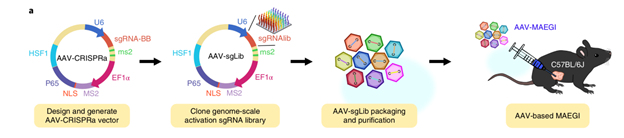
▲AAV-p-MAEGI療法示意圖(圖片來源:參考資料[2])進(jìn)一步的結(jié)果顯示�,AAV-p-MAEGI療法改變了腫瘤的微環(huán)境���,不僅提高了主要組織相融復(fù)合體 II(MHC-II)和抗原呈遞細(xì)胞(APC)的比例����,還提高了CD4陽性T細(xì)胞�、CD8陽性T細(xì)胞對(duì)腫瘤的浸潤(rùn),并改變了腫瘤浸潤(rùn)免疫細(xì)胞(TIIC)的成分��,這些最終導(dǎo)致了腫瘤的消退��。因?yàn)镸AEGI的全新作用機(jī)制����,使得它能夠獨(dú)立于已有的癌癥免疫療法�����。MAEGI理論上能與標(biāo)準(zhǔn)療法或者其他免疫療法結(jié)合����,有望帶來全新的治療方式�����,應(yīng)用于多種癌癥����。
本文題圖來自Pixabay。
參考資料:
[1] Marrying CRISPR with immuno-oncology to defeat remote tumors. Retrieved Oct. 14, 2019, from https://www.fiercebiotech.com/research/marrying-crispr-immuno-oncology-to-defeat-remote-tumors
[2] Chen. et al. (2019)Multiplexed activation of endogenous genes by CRISPRa elicits potent antitumor immunity. Nature Immunology. https://www.nature.com/articles/s41590-019-0500-4





