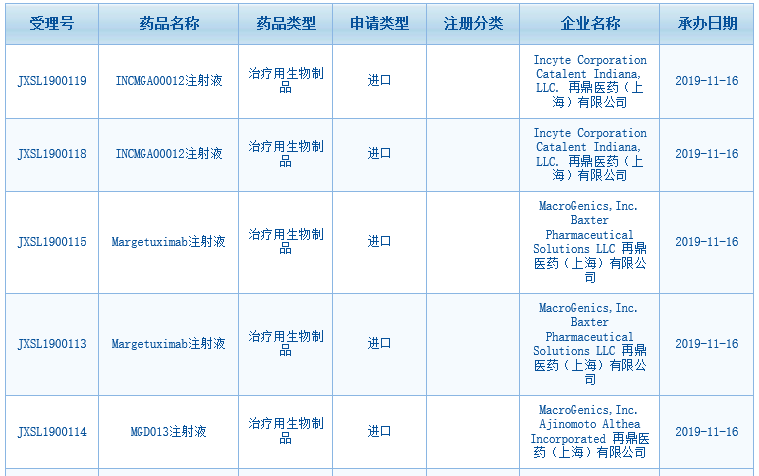
今日消息�����,再鼎醫(yī)藥3款從海外引進的在研產品申報臨床并獲得受理���!根據中國國家藥監(jiān)局藥品審評中心(CDE)網站最新數(shù)據顯示��,再鼎醫(yī)藥已在中國提交了HER2單抗Margetuximab注射液���、PD-1/ LAG-3雙特異性抗體MGD013注射液、PD-1單抗INCMGA00012注射液三款進口藥的臨床試驗申請����。這三款藥最初均由美國MacroGenics公司研發(fā)��,再鼎醫(yī)藥擁有它們在大中華區(qū)(中國大陸��、香港��、澳門和臺灣地區(qū))的獨家開發(fā)及商業(yè)化授權�����。
▲圖片來源:CDE官網截圖
Margetuximab是一款靶向人表皮生長因子受體2(HER2)的單克隆抗體藥物��。HER2在乳腺癌��、胃食管癌和其他實體瘤中均有表達�����。Margetuximab具有與曲妥珠單抗類似的HER2結合和抗增殖效應�����,而且MacroGenics公司還通過Fc優(yōu)化技術對margetuximab進行了工程設計,以增強其免疫系統(tǒng)的參與度��,并通過抗體依賴性細胞介導的細胞毒性作用(ADCC)提高對癌細胞的殺傷力�����。目前��,margetuximab正在多個癌種中開展臨床試驗�����。2019年10月25日�����,margetuximab針對胃癌或胃食管結合部癌患者的2/3期臨床研究MAHOGANY已完成首位患者給藥���,該研究旨在評估m(xù)argetuximab聯(lián)合免疫檢查點抑制劑、聯(lián)合或不聯(lián)合化療���,一線治療HER2陽性胃癌或胃食管結合部癌患者的療效���。此外,margetuximab聯(lián)合化療治療既往已接受抗HER2靶向療法治療的轉移性HER2陽性乳腺癌患者的3期SOPHIA研究也正在進行中。今年2月��,MacroGenics公司宣布���,SOPHIA 的3期臨床研究結果顯示����,在聯(lián)合化療的基礎上�����,與曲妥珠單抗的頭對頭比較����,margetuximab可更好地改善HER2陽性轉移性乳腺癌患者的無進展生存(PFS)。MGD013是MacroGenics公司利用DART?平臺開發(fā)的首個能夠同時與表達在T淋巴細胞表面的免疫檢查點分子PD-1和淋巴細胞活化基因3(LAG-3)相結合的雙特異性抗體����。MGD013在血清中的半衰期很長����,通過同時阻斷這兩個免疫檢查點分子的免疫抑制����,它具有治療多種實體瘤和惡性血液腫瘤的潛力����。ClinicalTrials.gov官網數(shù)據顯示,MacroGenics公司正在晚期實體瘤和血液腫瘤中開展一項關于MGD013的國際多中心1期臨床研究��,以評估MGD013的安全性和耐受性���,并確定MGD013的最大耐受劑量(MTD)。INCMGA0012是MacroGenics公司開發(fā)的一款處于試驗階段的抗PD-1單克隆抗體����,2017年10月,Incyte與MacroGenics簽訂了獨家全球合作和許可協(xié)議�����,獲得了INCMGA0012的全球權利���,但MacroGenics公司保留了使用INCMGA0012開發(fā)產品管線的權利�����。2019年7月�����,再鼎醫(yī)藥又通過與Incyte簽訂協(xié)議����,獲得了該藥在大中華區(qū)的獨家開發(fā)和商業(yè)化授權許可。目前��,Incyte公司正在高衛(wèi)星不穩(wěn)定性子宮內膜癌����、默克爾細胞癌和肛門癌中探索INCMGA0012單藥療法的療效,這三項研究均以注冊為目標���。此外�����,Incyte公司和MacroGenics公司正在分別開展INCMGA0012與其它藥物聯(lián)用的多項研究���。我們期待這三款藥物早日在中國獲批臨床并順利開展研究�����,為患者帶來更多的治療選擇��。