中國(guó)國(guó)家藥監(jiān)局藥品審評(píng)中心(CDE)網(wǎng)站最新公示顯示�����,阿諾醫(yī)藥在中國(guó)提交了PI3K抑制劑buparlisib (AN2025)的臨床試驗(yàn)申請(qǐng)��。Buparlisib最初由諾華公司(Novartis)開(kāi)發(fā)�����,阿諾醫(yī)藥現(xiàn)在擁有該藥的全球獨(dú)家權(quán)益�。目前�����,buparlisib尚未在全球任何國(guó)家和地區(qū)上市�。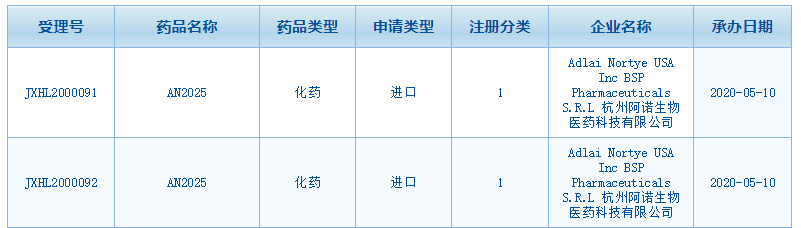
Buparlisib是一種具有腫瘤免疫(I/O)作用的口服泛PI3K抑制劑,可針對(duì)所有的I類PI3K亞型�����,在血液惡性腫瘤和實(shí)體瘤中都很活躍�。2018年7月,阿諾醫(yī)藥與諾華公司簽署一項(xiàng)全球許可協(xié)議��,通過(guò)支付首付款、里程碑金和銷售提成的方式��,獲得腫瘤治療藥物buparlisib 的全球獨(dú)家開(kāi)發(fā)���、生產(chǎn)與銷售權(quán)利�����。根據(jù)阿諾醫(yī)藥早前發(fā)布的新聞稿�,諾華此前已完成了buparlisib在與紫杉醇聯(lián)合治療頭頸部鱗狀細(xì)胞癌的全球臨床2期臨床試驗(yàn)��,并取得了良好的療效���,患者的中位生存時(shí)間達(dá)到了10.4個(gè)月�����?;诖?��,美國(guó)FDA已授予該藥快速審批通道資格�。此外,動(dòng)物試驗(yàn)數(shù)據(jù)顯示���,AN2025也有治療PD-1藥物無(wú)應(yīng)答或者PD-1耐受的腫瘤的潛力���。根據(jù)阿諾醫(yī)藥在2019年3月發(fā)布的動(dòng)物試驗(yàn)數(shù)據(jù)��,AN2025顯著抑制了腫瘤的生長(zhǎng)�,并且在PD-1無(wú)應(yīng)答的小鼠腫瘤治療中表現(xiàn)出劑量反應(yīng)的趨勢(shì)。目前���,buparlisib已獲得美國(guó)FDA批準(zhǔn)開(kāi)展3期臨床試驗(yàn)���,該研究將評(píng)估AN2025聯(lián)合紫杉醇治療與紫杉醇單獨(dú)治療頑固性、復(fù)發(fā)性或轉(zhuǎn)移性頭頸癌的效果�,參與3期臨床試驗(yàn)的患者將包含經(jīng)鉑類化療或PD-1治療失敗的病人。

在中國(guó)�����,本次是阿諾醫(yī)藥首次提交buparlisib 的臨床試驗(yàn)申請(qǐng)���。但是���,中國(guó)藥物臨床試驗(yàn)登記與信息公示平臺(tái)��,諾華早前已在晚期實(shí)體腫瘤��、局部晚期或轉(zhuǎn)移性乳腺癌中開(kāi)展了兩項(xiàng)關(guān)于buparlisib的研究��。



