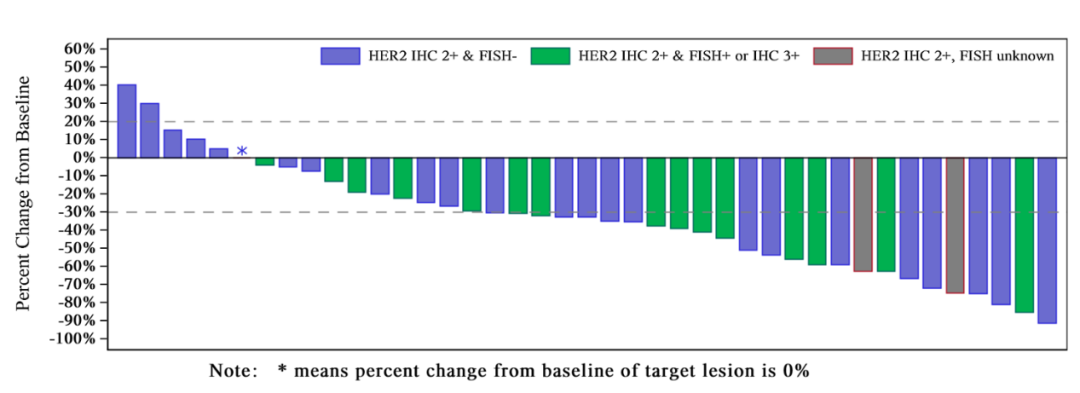
近日����,榮昌生物制藥(煙臺)股份有限公司(RemeGen)宣布自主研發(fā)的抗體-藥物偶聯(lián)(ADC)藥物注射用緯迪西妥單抗(Disitamab vedotin�,商品名:愛地希?��,研究代號:RC48)獲得美國FDA的突破性療法認(rèn)定(Breakthrough Therapy Designation)���,適應(yīng)癥為HER2表達(dá)的(IHC 2+或IHC 3+)局部晚期或轉(zhuǎn)移性尿路上皮癌患者的二線治療����。幾個月前,該新藥已被美國FDA授予快速通道認(rèn)定���。突破性療法源于《美國食品和藥物管理局安全及創(chuàng)新法案》(FDASIA)規(guī)定,旨在加速開發(fā)及審查治療嚴(yán)重或威脅生命疾病的新藥�。作為繼快速通道、加速批準(zhǔn)���、優(yōu)先審評以后美國FDA的又一個新藥評審?fù)ǖ?��,獲得突破性療法認(rèn)證的藥物開發(fā)能得到包括FDA高層官員在內(nèi)的更加密切的指導(dǎo),保障在最短時間內(nèi)為患者提供新的治療選擇�。緯迪西妥單抗獲得FDA突破性療法認(rèn)定,意味著該新藥臨床數(shù)據(jù)較現(xiàn)有治療手段顯示出顯著療效�,將加速推進(jìn)臨床開發(fā)進(jìn)程,早日滿足患者需求�。根據(jù)2019年美國臨床腫瘤學(xué)會(American Society of Clinical Oncology, ASCO)年會上公布的由北京大學(xué)腫瘤醫(yī)院副院長郭軍教授牽頭的研究結(jié)果顯示:在接受RC48-ADC治療的43例二線及多線尿路上皮癌受試者中,確證客觀緩解率(cORR)高達(dá)51.2%���,疾病控制率(DCR)高達(dá)90.7%�����。目前�,國內(nèi)外尚未有治療HER2陽性尿路上皮癌的藥品獲得上市批準(zhǔn)。RC48的上述療效結(jié)果實現(xiàn)了重大突破�,不僅有效率高,而且大幅延長了一線治療失敗后患者的生存期�����,填補(bǔ)了巨大醫(yī)學(xué)需求�。2020年8月27日,緯迪西妥單抗用于治療局部晚期或轉(zhuǎn)移性胃癌(包括胃食管結(jié)合部腺癌)患者的新藥上市申請被中國國家藥品監(jiān)督管理局正式受理���,并被納入優(yōu)先審評審批程序���,這是在中國第一個提交新藥上市申請的自主研發(fā)的ADC藥物。該藥物還在2018年9月獲得美國FDA胃癌孤兒藥資格認(rèn)證���,計劃將于2021年在美國進(jìn)行用于胃癌的II期臨床試驗���。緯迪西妥單抗還在我國開展了HER2低表達(dá)乳腺癌III期臨床研究,明年將在美國啟動III期臨床研究����。2021年,緯迪西妥單抗將在國內(nèi)開展多個適應(yīng)癥的II/III期臨床研究����。根據(jù)美通社的預(yù)測顯示���,2025年ADC藥物市場規(guī)模將達(dá)到99.3億美元,復(fù)合年增長率有望將達(dá)到25.9%�����。由于ADC結(jié)構(gòu)復(fù)雜���,其工藝開發(fā)和單克隆抗體的傳統(tǒng)生產(chǎn)涉及更高的技術(shù)難度和復(fù)雜性。榮昌生物擁有一個全面集成ADC開發(fā)和生產(chǎn)平臺�,涵蓋ADC開發(fā)及生產(chǎn)的整個過程,擁有符合全球GMP要求的生產(chǎn)設(shè)施�。利用獨有、強(qiáng)大的ADC平臺���,榮昌生物開發(fā)了一系列ADC藥物��,除了RC48已在中國申請新藥上市外��,RC88正在進(jìn)行I期臨床試驗�����,RC108已申報臨床并獲國家藥品監(jiān)督管理局藥品評審中心(CDE)受理���,且今后幾年每年都會有進(jìn)入臨床研究階段的ADC候選藥物�����,前景無限�。