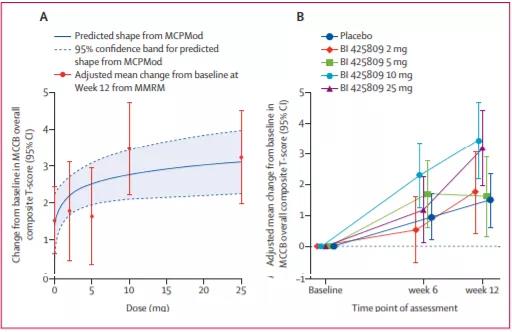
5月24日,勃林格殷格翰(BI)宣布���,F(xiàn)DA授予 BI425809用于治療精神分裂癥相關(guān)認(rèn)知障礙(CIAS)突破性療法認(rèn)定(BTD)���。該公司還宣布,計劃啟動一項(xiàng)創(chuàng)新型III期CONNEX臨床試驗(yàn)�,用于評估BI 425809在改善成人精神分裂癥患者認(rèn)知方面的安全性和有效性�����。認(rèn)知障礙是精神分裂癥的一個核心特征��,可見于大多數(shù)精神分裂癥患者���,其可導(dǎo)致患者日常功能障礙。這一領(lǐng)域尚存在巨大的未滿足臨床需求����,目前沒有治療CIAS藥物獲批上市。N-甲基-D-天冬氨酸(NMDA)受體介導(dǎo)的谷氨酸能神經(jīng)傳遞功能障礙是精神分裂癥和阿爾茨海默癥認(rèn)知功能損害的病理原因�����,甘氨酸是NMDA受體介導(dǎo)的信號轉(zhuǎn)導(dǎo)所需要的一種協(xié)同激動劑(coagonist)����。BI 425809片是勃林格殷格翰開發(fā)的一款甘氨酸轉(zhuǎn)運(yùn)蛋白1(Gly-T1)抑制劑,旨在通過抑制Gly-T1�����,提高突觸甘氨酸水平,從而增強(qiáng)谷氨酸能神經(jīng)傳遞和下游的神經(jīng)可塑性過程���,起到治療作用�。這項(xiàng)突破性療法認(rèn)定和III期試驗(yàn)的啟動是基于II期研究(NCT02832037)結(jié)果��,該研究旨在評估BI 425809(每日口服1次 )2 mg, 5 mg, 10 mg, 25 mg vs.安慰劑治療精神分裂癥相關(guān)認(rèn)知障礙療效和安全性�。主要終點(diǎn)為第12周時患者M(jìn)CCB總體綜合T評分(一種精神分裂癥神經(jīng)認(rèn)知療效評定測試)較基線的變化值。共有509例患者接受治療��,444例患者 (87%)完成了12周治療���。MCP-Mod(一種劑量評估模型)分析結(jié)果顯示���,BI 425809 10mg和25mg劑量組的MCCB總體復(fù)合T評分與基線的變化值較安慰劑組差異最大(調(diào)整后的平均差異:10mg:1.98�,25mg:1.73)。BI 425809各劑量組( 2 mg�,5 mg,10 mg�,25mg)和安慰劑不良反應(yīng)發(fā)生率相當(dāng),分別為59%����,52%,41%,42%和44%CONNEX是一個III期臨床試驗(yàn)項(xiàng)目����,由3個臨床試驗(yàn)組成,包括connex 1�、connex 2和connex 3,這3個臨床試驗(yàn)都是III期隨機(jī)���、雙盲����、安慰劑對照���、平行試驗(yàn)��,以評估BI 425809在26周治療期內(nèi)的療效和安全性�����。研究的主要終點(diǎn)為MCCB總體綜合T評分較基線的變化值���。BI還將使用VeraSci公司的虛擬現(xiàn)實(shí)功能能力評估測試(VRFCAT)作為關(guān)鍵次要終點(diǎn)。
值得注意的是�,今年3月24日���,BI 425809已在國內(nèi)獲批臨床。