免疫檢查點(diǎn)抑制劑能夠調(diào)節(jié)T細(xì)胞的活性,讓它們重新發(fā)揮抗腫瘤的作用,最終實(shí)現(xiàn)消滅癌細(xì)胞的目的。盡管有一些患者能從這一免疫療法中受益���,但還是有許多人容易出現(xiàn)藥物抗性,甚至是完全對(duì)藥物沒有反應(yīng)��。《癌癥細(xì)胞》的一項(xiàng)新研究發(fā)現(xiàn)���,一種常見的抗過敏藥物或許能夠幫助這部分患者���,增強(qiáng)他們對(duì)免疫療法的敏感性。

為了調(diào)查哪些藥物能影響檢查點(diǎn)抑制劑的效果�����,得克薩斯大學(xué)MD安德森癌癥中心的研究者對(duì)過往接受過該療法的患者臨床數(shù)據(jù)進(jìn)行了回顧性分析�����。盡管不同癌癥類型的樣本數(shù)量不一�����,但與生存狀況改善有關(guān)的藥物都指向了一個(gè)結(jié)果:靶向組胺受體H1(HRH1)的抗組胺藥���,這類藥物原本主要用于抗過敏和治療皮疹。尤其是黑色素瘤和肺癌患者,他們同時(shí)使用檢查點(diǎn)抑制劑和靶向HRH1藥物時(shí)明顯與病情改善有關(guān)�����。此外�����,乳腺癌和結(jié)腸癌患者也表現(xiàn)出了同樣的趨勢(shì)����。利用癌癥基因圖譜和患者的數(shù)據(jù),研究者發(fā)現(xiàn)腫瘤高度表達(dá)HRH1的時(shí)候����,T細(xì)胞的功能也會(huì)出現(xiàn)紊亂,并且與檢查點(diǎn)抑制劑療效不佳�����、生存率下降有關(guān)�����。
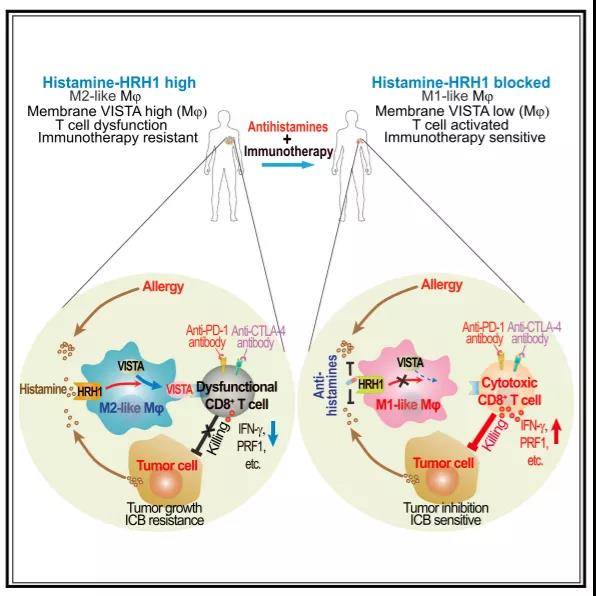
▲新研究示意圖(圖片來源:參考資料[2])
這些結(jié)果也讓研究者推測(cè)����,HRH1和組胺或許決定著患者對(duì)免疫療法的敏感性��。在后續(xù)的研究中���,他們發(fā)現(xiàn)腫瘤微環(huán)境中兩種蛋白的表達(dá)量會(huì)同時(shí)上升,但兩者并非來自同一個(gè)地方�����。HRH1并沒有出現(xiàn)在癌細(xì)胞表面�����,反而是一類特殊的腫瘤相關(guān)巨噬細(xì)胞(TAM)會(huì)高度表達(dá)�。這類TAM也被稱作M2型巨噬細(xì)胞,能夠抑制免疫系統(tǒng)的功能�����。那它們是怎么發(fā)揮功能的�?結(jié)果仍然是癌細(xì)胞在作祟,癌細(xì)胞會(huì)源源不斷地分泌組胺刺激TAM���,那些對(duì)檢查點(diǎn)抑制劑不敏感患者的樣本往往組胺水平都很高���。研究者在小鼠模型中發(fā)現(xiàn),無論是基因敲除還是使用抗組胺治療來阻止巨噬細(xì)胞HRH1的功能����,都能降低M2型TAM的活性。并且這些方式能夠恢復(fù)T細(xì)胞的活性���,阻止腫瘤的生長(zhǎng)�。

圖片來源:123RF
實(shí)際上��,降低HIRI的活性還能夠使得巨噬細(xì)胞表面一種名為VISTA的受體膜定位出現(xiàn)異常�,這種受體已經(jīng)被過往研究發(fā)現(xiàn)能夠阻止T細(xì)胞的活化,此舉或許是抗組胺藥物真正發(fā)揮用處的原因��。而受到影響的TAM還會(huì)由抑制免疫的M2型逐漸轉(zhuǎn)向能促進(jìn)炎癥的M1型�����。根據(jù)臨床前的研究結(jié)果�����,研究者已經(jīng)確認(rèn)抗組胺藥物與免疫檢查點(diǎn)抑制劑聯(lián)用時(shí)���,能夠提升藥物的抗癌效果����,延長(zhǎng)生存期。目前����,研究團(tuán)隊(duì)正在臨床試驗(yàn)中對(duì)此聯(lián)合療法進(jìn)行評(píng)估。“抗組胺藥物有可能可以增強(qiáng)患者對(duì)免疫療法的反應(yīng)����,特別是血液中組胺水平很高的患者,”研究的通訊作者余棣華教授表示���,“抗組胺藥物提供了一種廉價(jià)且副作用小的抗癌方法����?�!?/span>
參考資料:
[1] Antihistamines can influence immunotherapy response by enhancing T cell activation. Retrieved Nov 26th, 2021 from https://www.eurekalert.org/news-releases/935552
[2] Dihua Yu, The allergy mediator histamine confers immunotherapy resistance in cancer patients via activation of the macrophage histamine receptor 1, Cancer Cell (2021). DOI: 10.1016/j.ccell.2021.11.002.




