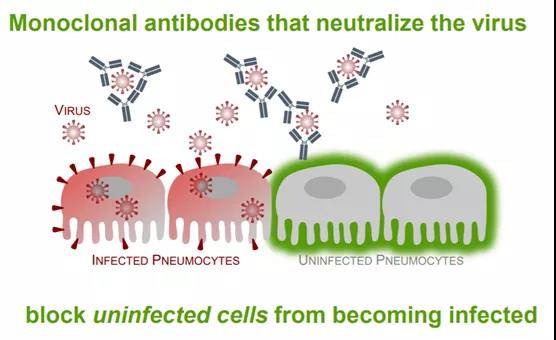
12月8日�����,騰盛博藥旗下控股公司騰盛華創(chuàng)抗新冠病毒中和抗體安巴韋單抗/羅米司韋單抗聯(lián)合療法(以前稱BRII-196/BRII-198聯(lián)合療法)獲中國(guó)國(guó)家藥品監(jiān)督管理局(NMPA)應(yīng)急批準(zhǔn)��。該聯(lián)合療法的獲批不僅意味著中國(guó)迎來(lái)了首款新冠病毒中和抗體治療藥物����,也標(biāo)志著中國(guó)生物醫(yī)藥企業(yè)和科研人員在新冠中和抗體的研發(fā)中實(shí)現(xiàn)了“零”的突破�。眾所周知,一款新藥的誕生至少需要10年左右的時(shí)間���。而此次獲批的安巴韋單抗/羅米司韋單抗聯(lián)合療法從最初的實(shí)驗(yàn)室研究到獲批僅用了不到20個(gè)月的時(shí)間��。那么�����,這款新冠中和抗體聯(lián)合療法何以能在這么短的時(shí)間內(nèi)獲批���?在疫情期間�����,它的開(kāi)發(fā)又經(jīng)歷了哪些特殊的挑戰(zhàn)��?本文中�����,讓我們一起來(lái)回顧下中國(guó)首款新冠病毒中和抗體聯(lián)合治療藥物的誕生之旅��。圖片來(lái)源:藥明康德內(nèi)容團(tuán)隊(duì)制作與時(shí)間賽跑�����,4個(gè)月拿到IND批件時(shí)鐘撥回到2020年初的冬天���,一場(chǎng)突如其來(lái)的新冠疫情打亂了我們的正常生活。面對(duì)一種前所未知的新冠病毒��,許多生物醫(yī)藥公司和研究者都第一時(shí)間投身到了這場(chǎng)沒(méi)有硝煙的戰(zhàn)爭(zhēng)中��。小分子抗病毒藥物��、新冠疫苗、中和抗體……���,科學(xué)家們紛紛從不同的領(lǐng)域著手��,以求盡快找到應(yīng)對(duì)新冠疫情的方法����,騰盛博藥就是其中的一員����。“騰盛博藥致力于針對(duì)重大感染性疾病以及其它重大公共衛(wèi)生疾病開(kāi)發(fā)創(chuàng)新療法。在傳染病研究領(lǐng)域����,尤其是呼吸道病毒藥物研發(fā)領(lǐng)域,我們擁有豐富的研究經(jīng)驗(yàn)����。新冠疫情爆發(fā)后�,公司毫不猶豫地決定進(jìn)行新冠中和抗體療法的開(kāi)發(fā),希望用我們的所長(zhǎng)為人類抗擊疫情貢獻(xiàn)一份力量��?���!彬v盛博藥高級(jí)副總裁兼生物制藥部門負(fù)責(zé)人朱青博士在接受藥明康德內(nèi)容團(tuán)隊(duì)采訪表示�����。 提到中和抗體��,大家最熟悉的可能是它的中和功能���。中和抗體通過(guò)與病毒表面的特異性抗原相結(jié)合,防止它們與細(xì)胞上表達(dá)的受體相結(jié)合并進(jìn)入細(xì)胞�����,進(jìn)而防止病毒感染尚未受到感染的細(xì)胞��。以針對(duì)新冠病毒的中和抗體為例�,多款抗體都靶向新冠病毒刺突蛋白的受體結(jié)合域(RBD)。RBD是刺突蛋白與細(xì)胞上的ACE2受體結(jié)合的關(guān)鍵蛋白域��,通過(guò)阻斷它們之間的相互作用可以防止新冠病毒感染人體細(xì)胞���。▲中和抗體阻止病毒感染細(xì)胞示意圖(圖片來(lái)源:參考資料[4])談及中和抗體的優(yōu)勢(shì)���,朱青博士表示:“與疫苗相比�,中和抗體不但可用于治療受到新冠病毒感染的患者����,而且能夠作為預(yù)防性療法,給容易受到感染的高危人群提供被動(dòng)免疫能力�����。在預(yù)防性療法方面�����,中和抗體的優(yōu)勢(shì)還體現(xiàn)在患者接受注射后能夠立即生效����,對(duì)那些不能對(duì)疫苗產(chǎn)生足夠免疫應(yīng)答的人群(例如老年人和免疫系統(tǒng)受到抑制的患者)同樣有效?��!?/span>為何從一開(kāi)始就選擇了“雞尾酒”聯(lián)合療法����,則是源于騰盛博藥團(tuán)隊(duì)豐富的抗病毒藥物研發(fā)經(jīng)驗(yàn)����。“新冠病毒是RNA病毒��,從歷史經(jīng)驗(yàn)及病毒學(xué)原理來(lái)看����,RNA病毒的突變率一般都很高,因此在設(shè)計(jì)之初�����,我們就決定開(kāi)發(fā)‘雞尾酒’療法�,也就是希望通過(guò)具有不同作用機(jī)制的中和抗體聯(lián)合用藥,來(lái)預(yù)防未來(lái)可能會(huì)出現(xiàn)的病毒突變情況�����?����!敝烨嗖┦拷榻B道��。這是一個(gè)與時(shí)間賽跑的過(guò)程��。為了能夠以最快的速度找到合適的中和抗體�����,騰盛博藥決定通過(guò)合作來(lái)加快研發(fā)進(jìn)程。在快速調(diào)研后����,騰盛博藥發(fā)現(xiàn)清華大學(xué)張林琦教授與深圳市第三人民醫(yī)院張政教授的研究團(tuán)隊(duì)已經(jīng)從中國(guó)被治愈的COVID-19患者中發(fā)現(xiàn)了多個(gè)具有治療COVID-19潛力的全人源單克隆中和抗體。于是���,三方很快建立了合作�����,于2020年初共同成立騰盛華創(chuàng)以推動(dòng)中和抗體的研發(fā)�����。遠(yuǎn)在美國(guó)的朱青博士也立刻趕回中國(guó)���,日夜奮戰(zhàn)參與到研究中。在多方的齊心協(xié)力下�,研究人員終于篩選出了兩款具有不同結(jié)合位點(diǎn)的新冠中和抗體——安巴韋單抗和羅米司韋單抗。據(jù)朱青博士介紹�����,安巴韋單抗和羅米司韋單抗是兩款非競(jìng)爭(zhēng)性結(jié)合新冠病毒刺突蛋白中和抗體���,對(duì)新冠病毒均具有高度中和活性����。此外�����,研究人員還應(yīng)用了生物工程技術(shù)����,以降低抗體介導(dǎo)依賴性增強(qiáng)作用的風(fēng)險(xiǎn),并通過(guò)對(duì)每種抗體的可結(jié)晶片段區(qū)域(Fc段)進(jìn)行修飾��,以延長(zhǎng)抗體的半衰期���,以期獲得更持久的治療效果�。基于這樣的抗體設(shè)計(jì)��,由安巴韋單抗和羅米司韋單抗組成的“雞尾酒”療法可以非競(jìng)爭(zhēng)性地識(shí)別新冠病毒刺突蛋白R(shí)BD中獨(dú)特的表位���,減少在抗體治療過(guò)程中產(chǎn)生抗藥性病毒的機(jī)會(huì)����,進(jìn)而增加抗體與未來(lái)病毒變種結(jié)合的可能性。2020年7月��,安巴韋單抗/羅米司韋單抗聯(lián)合療法的臨床試驗(yàn)申請(qǐng)獲得中國(guó)國(guó)家藥監(jiān)局藥品審評(píng)中心(CDE)批準(zhǔn)�����,成為了當(dāng)時(shí)全球范圍內(nèi)最早進(jìn)入臨床試驗(yàn)的新冠中和抗體之一�����?�!?strong style="margin: 0px; padding: 0px; outline: 0px; max-width: 100%; box-sizing: border-box !important; overflow-wrap: break-word !important;">從抗體的最初篩選到開(kāi)始人體試驗(yàn)��,我們只用了不到4個(gè)月時(shí)間����。在新藥研發(fā)領(lǐng)域,尤其是在抗病毒抗體的藥物研發(fā)領(lǐng)域�����,這一速度幾乎是前所未有的?!敝烨嗖┦可钣懈杏|地說(shuō)到。圖片來(lái)源:騰盛博藥提供�,藥明康德內(nèi)容團(tuán)隊(duì)制作通常情況下����,獲得臨床批件后�����,研究人員就可以招募患者開(kāi)展臨床研究����。但隨著2020年7月中國(guó)的疫情得到基本控制,新冠患者越來(lái)越少���,這意味著臨床試驗(yàn)很難再招募到患者��。因此����,騰盛博藥團(tuán)隊(duì)決定暫停中國(guó)的臨床研究�����,轉(zhuǎn)移至美國(guó)進(jìn)行安巴韋單抗/羅米司韋單抗聯(lián)合療法的臨床試驗(yàn)申請(qǐng)。做出這個(gè)決定并不容易����,因?yàn)檫@意味著人力、物力����、財(cái)力等多方面的壓力和挑戰(zhàn),但騰盛博藥團(tuán)隊(duì)并沒(méi)有猶豫����。2020年9月,朱青博士回到美國(guó)���,開(kāi)始主導(dǎo)安巴韋單抗/羅米司韋單抗聯(lián)合療法的臨床申報(bào)和研究開(kāi)展���。盡管彼時(shí)在美國(guó)開(kāi)展新冠抗體臨床研究項(xiàng)目較多,患者招募面臨競(jìng)爭(zhēng)壓力�����,但得益于該聯(lián)合療法在健康人群中取得的良好安全性數(shù)據(jù)�,安巴韋單抗/羅米司韋單抗聯(lián)合療法得到了美國(guó)國(guó)立衛(wèi)生研究院(NIH)下屬的國(guó)家過(guò)敏和傳染病研究所(NIAID)的支持和資助�����,使得這一研究(ACTIV-2)得以快速推進(jìn)��。ACTIV-2是一項(xiàng)全球多中心的2/3期臨床試驗(yàn)��,在美國(guó)���、巴西����、南非、墨西哥��、阿根廷和菲律賓等全球多個(gè)臨床試驗(yàn)中心開(kāi)展����,其中3期臨床試驗(yàn)部分在全球入組了847位受試者。而今年6月以來(lái)��,隨著中國(guó)新冠疫情在多地點(diǎn)狀出現(xiàn)�����,騰盛博藥也在中國(guó)啟動(dòng)了安巴韋單抗/羅米司韋單抗聯(lián)合療法在中國(guó)的2期臨床。安巴韋單抗/羅米司韋單抗聯(lián)合療法的治療優(yōu)勢(shì)也在臨床試驗(yàn)中得到了進(jìn)一步的驗(yàn)證�����。ACTIV-2研究3期最終臨床試驗(yàn)結(jié)果顯示:與安慰劑相比��,安巴韋單抗/羅米司韋單抗聯(lián)合療法將臨床進(jìn)展為重度疾病高風(fēng)險(xiǎn)的COVID-19門診患者的住院和死亡風(fēng)險(xiǎn)降低80%�����;對(duì)早期開(kāi)始接受治療(癥狀出現(xiàn)后5天內(nèi))的受試者�,與晚期開(kāi)始接受治療(癥狀出現(xiàn)后6至10天內(nèi))的受試者相比,安巴韋單抗/羅米司韋單抗治療組均觀察到顯著的住院和死亡率降低�����。而且����,安巴韋單抗/羅米司韋單抗聯(lián)合療法在安全性上也顯著優(yōu)于安慰劑組。在2021年9月30日舉辦的2021年美國(guó)感染性疾病周(IDWeek)年會(huì)上����,騰盛博藥通過(guò)口頭報(bào)告形式公布了ACTIV-2研究3期的出色中期數(shù)據(jù)?��;谶@一積極的臨床試驗(yàn)數(shù)據(jù)��,騰盛博藥在今年10月初向美國(guó)FDA提交了安巴韋單抗/羅米司韋單抗聯(lián)合療法的緊急使用授權(quán)(EUA)申請(qǐng)���,并同步將3期臨床中期報(bào)告遞交中國(guó)國(guó)家藥監(jiān)局藥品審評(píng)中心(CDE)�。此次該聯(lián)合療法在中國(guó)被應(yīng)急批準(zhǔn)���,用于治療輕型和普通型且伴有進(jìn)展為重型(包括住院或死亡)高風(fēng)險(xiǎn)因素的成人和青少年(12-17歲�����,體重≥40 kg)新型冠狀病毒感染(COVID-19)患者。其中青少年(12-17歲��,體重≥40 kg)適應(yīng)癥人群為附條件批準(zhǔn)輕型和普通型且伴有進(jìn)展為重型(包括住院或死亡)高風(fēng)險(xiǎn)因素的成人COVID-19患者�����,并附條件批準(zhǔn)用于兒童(≥12歲�,體重≥40 kg)COVID-19患者。這一聯(lián)合療法在中國(guó)的獲批�,標(biāo)志著中國(guó)擁有了首個(gè)自主研發(fā)并經(jīng)過(guò)國(guó)際多中心大樣本隨機(jī)、雙盲��、安慰劑對(duì)照研究證明有效的新冠病毒中和抗體聯(lián)合治療藥物。而此時(shí)����,距這款聯(lián)合療法最初的實(shí)驗(yàn)室研究?jī)H不到20個(gè)月的時(shí)間。在朱青博士看來(lái)���,“這樣的速度不僅是基于騰盛博藥自身在抗病毒藥物領(lǐng)域擁有豐富的研發(fā)經(jīng)驗(yàn)和高效的執(zhí)行力���,更得益于科研院所、醫(yī)院����、CRO、以及政府機(jī)構(gòu)的之間的相互合作和支持”��。眾所周知,隨著疫情的延續(xù)��,新冠病毒也出現(xiàn)了許多變異株�。如何應(yīng)對(duì)新冠病毒變異株成為了行業(yè)面臨的又一挑戰(zhàn)。由于安巴韋單抗/羅米司韋單抗聯(lián)合療法的臨床研究比其它已獲FDA批準(zhǔn)的新冠中和抗體晚了一些��,ACTIV-2試驗(yàn)3期研究剛好入組了包括2021年1月至7月出現(xiàn)的新冠病毒變異株患者。作為3期研究分析的一部分���,研究人員也將評(píng)估安巴韋單抗/羅米司韋單抗聯(lián)合療法對(duì)不同類型新冠病毒變異株的臨床有效性�。根據(jù)目前的體外嵌合病毒實(shí)驗(yàn)數(shù)據(jù)�����,安巴韋單抗/羅米司韋單抗聯(lián)合療法對(duì)廣受關(guān)注的主要病毒變異株均保持中和活性�����,包括“阿爾法”(Alpha)��、“貝塔”(Beta)����、“伽馬”(Gamma)�����、“伊普西龍”(Epsilon)���、“德?tīng)査保―elta)���、“德?tīng)査?”(Delta Plus)��、“拉姆達(dá)”(Lambda)�、以及“繆”(Mu)�。騰盛博藥也正在開(kāi)展針對(duì)“奧米克戎(Omicron)變異株的測(cè)試。尤其引人關(guān)注的是���,該聯(lián)合療法對(duì)今年流行的“德?tīng)査弊儺愔旮腥净颊叩闹委熜Ч?�,已在一些臨床救治中得到初步驗(yàn)證���。今年6月以來(lái),中國(guó)多個(gè)城市曾出現(xiàn)“德?tīng)査弊儺愔旮腥净颊?��。?jù)騰盛博藥總裁兼大中華區(qū)總經(jīng)理羅永慶先生介紹���,騰盛博藥通過(guò)與中國(guó)政府部門和醫(yī)院合作,捐贈(zèng)了近3,000人份的安巴韋單抗和羅米司韋單抗�,涉及廣東省、云南省�、江蘇省、湖南省、河南省��、福建省����、寧夏自治區(qū)、甘肅省����、內(nèi)蒙古自治區(qū)、黑龍江省���、青海省����、貴州省及遼寧省����,救治了近900例患者。很多人好奇����,在最初設(shè)計(jì)這款聯(lián)合療法的時(shí)候�,還沒(méi)有“德?tīng)査弊儺愔辏芯繄F(tuán)隊(duì)是如何做到對(duì)“德?tīng)査弊儺愔甑母采w的。但這對(duì)于騰盛博藥和朱青博士而言��,并不意外���?!把芯吭O(shè)計(jì)之初����,我們就考慮到了新冠病毒未來(lái)可能會(huì)出現(xiàn)變異,所以才篩選了兩個(gè)具有不同作用機(jī)制的中和抗體����,開(kāi)展聯(lián)合療法的研究。現(xiàn)在來(lái)看���,我們當(dāng)初的開(kāi)發(fā)策略是非常正確的�����?����!敝烨嗖┦炕貞?yīng)說(shuō)����。騰盛博藥還將在中國(guó)開(kāi)展進(jìn)一步研究,旨在評(píng)估安巴韋單抗/羅米司韋單抗聯(lián)合療法在免疫抑制人群中的預(yù)防免疫增強(qiáng)作用�����。新冠疫情的爆發(fā)�,尤其是新冠病毒的不斷變異,給疫苗以及中和抗體的開(kāi)發(fā)帶來(lái)了巨大的挑戰(zhàn)��。而騰盛博藥和合作伙伴共同開(kāi)發(fā)中和抗體聯(lián)合療法的曲折歷程����,正是這一時(shí)代背景下的縮影。回顧過(guò)往一年多的歷程��,朱青博士經(jīng)歷和見(jiàn)證了許多難忘且感動(dòng)的故事:為了和時(shí)間賽跑����,公司與合作伙伴、政府機(jī)構(gòu)全力合作的畫(huà)面��;研究團(tuán)隊(duì)不辭辛苦�����,夜以繼日工作的情形;以及她在“隔離房”中寫(xiě)申報(bào)材料的時(shí)光……�,一切歷歷在目�。當(dāng)下,人類與新冠病毒的斗爭(zhēng)還在持續(xù)����。在藥明康德2020年2月舉辦的“科學(xué)戰(zhàn)疫線上論壇”上,騰盛博藥聯(lián)合創(chuàng)始人兼首席執(zhí)行官(CEO)洪志博士曾表示�,“COVID-19的疫情提醒了所有人,傳染病不會(huì)從我們的生活中消失����,它們正在影響所有人的生活方式,我們必須學(xué)習(xí)如何做好準(zhǔn)備和應(yīng)對(duì)�����。我認(rèn)為���,沒(méi)有一個(gè)政府�����,一個(gè)國(guó)家�,一個(gè)行業(yè),一個(gè)醫(yī)療保健系統(tǒng)可單獨(dú)完成這一任務(wù)���,我們必須共同努力���,更好地開(kāi)展合作,共同應(yīng)對(duì)這樣的公共衛(wèi)生危機(jī)���?��!?/span>回顧過(guò)去的兩年,無(wú)論是新冠疫苗����、中和抗體,還是小分子抗病毒藥物�,一次次創(chuàng)記錄的開(kāi)發(fā)速度都離不開(kāi)企業(yè)、科研院所����、CRO、政府機(jī)構(gòu)等之間的齊心協(xié)力合作�。騰盛博藥相信,在社會(huì)各界人士的共同努力下����,人類一定能夠開(kāi)發(fā)出應(yīng)對(duì)新冠病毒不斷變異的疫苗和治療藥物����,讓我們?cè)缛栈貧w正常的生活��!
文章來(lái)源:醫(yī)藥觀瀾