在癌細胞表面表達的PD-L1蛋白通過與免疫細胞表面表達的PD-1受體相結(jié)合,抑制抗癌免疫反應(yīng)的作用機制幫助開發(fā)了革命性的創(chuàng)新免疫療法����。然而這并不是PD-L1的唯一作用,近年的研究發(fā)現(xiàn)���,PD-L1對表達它的癌細胞的生長和生存�����、干細胞特性、DNA損傷應(yīng)答和基因調(diào)控等多個方面都能產(chǎn)生影響。很多效果與PD-1無關(guān)�。這些發(fā)現(xiàn)表明,PD-L1介導(dǎo)的細胞外信號通路雖然帶來有效抗癌療法�,但并沒有完整反映了PD-L1作用的全貌。近日���,Nature Reviews Cancer上發(fā)表的一篇綜述對PD-L1介導(dǎo)的癌細胞內(nèi)信號通路進行了盤點�����。今日�,藥明康德內(nèi)容團隊將與讀者分享其中的部分精彩內(nèi)容���,點擊文末“閱讀全文/Read more”����,即可訪問綜述網(wǎng)址����。

PD-L1結(jié)構(gòu)和介導(dǎo)癌細胞內(nèi)信號傳導(dǎo)的方式
PD-L1蛋白包含5個主要蛋白域。我們通常提到的PD-L1蛋白指的是人類的全長PD-L1蛋白�,它不但在表達在細胞表面的時候能夠介導(dǎo)癌細胞內(nèi)的信號傳導(dǎo),而且在細胞內(nèi)也可以調(diào)節(jié)一系列信號通路��。PD-L1至少有6種亞型,這些亞型因為結(jié)構(gòu)不同����,在信號傳導(dǎo)的能力上也有顯著的區(qū)別。有些亞型可能具有重要的功能和預(yù)后影響�����,比如在復(fù)發(fā)型非小細胞肺癌患者中發(fā)現(xiàn)一種分泌的PD-L1亞型可以通過與抗PD-L1抗體結(jié)合�,介導(dǎo)對免疫檢查點抑制劑的耐藥性。
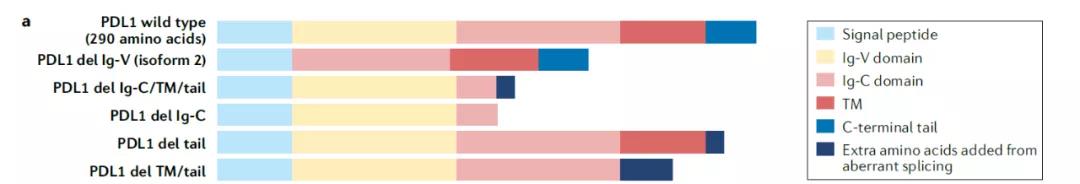
▲PD-L1的蛋白結(jié)構(gòu)域和亞型(圖片來源:參考資料[1])
位于細胞表面的全長PD-L1通過與PD-1結(jié)合�����,能夠通過細胞內(nèi)的C端蛋白域介導(dǎo)不同的信號通路�����。比如����,黑色素瘤中,癌細胞表面表達的PD-1通過與PD-L1結(jié)合����,能夠激活mTORC1���,并導(dǎo)致細胞增殖和動物模型中腫瘤的生長���。與之相反��,在非小細胞肺癌細胞和動物模型中���,PD-1和PD-L1結(jié)合引發(fā)的PD-L1介導(dǎo)信號會抑制MAPK-ERK信號傳導(dǎo),抑制腫瘤生長���?����?茖W(xué)家們?nèi)匀恍枰嗟难芯縼斫忉尣煌┌Y種類中PD-L1介導(dǎo)信號的不同作用����。這可能與特定遺傳背景���、腫瘤生物學(xué)��、或細胞特異性轉(zhuǎn)譯后PD-L1或PD-1的修飾相關(guān)���。細胞內(nèi)存在的PD-L1介導(dǎo)的信號細胞內(nèi)的全長PD-L1蛋白雖然與表達在細胞表面的PD-L1蛋白序列相同�,但是它的N端結(jié)構(gòu)域很可能沒有完成折疊�����,因此讓細胞內(nèi)PD-L1與不同的蛋白和其它生物分子相結(jié)合�����。值得關(guān)注的是����,細胞質(zhì)中的PD-L1能夠與mRNA結(jié)合并穩(wěn)定mRNA,導(dǎo)致特定DNA損傷修復(fù)蛋白表達水平的上升����。在特定三陰性乳腺癌細胞系中,細胞核周或核內(nèi)的PD-L1可以與DNA依賴性蛋白激酶結(jié)合�,激活MAPK或ERKs,促進細胞生存信號傳導(dǎo)��。這兩種作用機制能夠在不依賴PD-1或CD80這兩種可以與PD-L1結(jié)合的蛋白的情況下�����,促進對某些細胞毒性化療的耐藥性。細胞核內(nèi)的PD-L1還可以直接與DNA相結(jié)合����,綜述作者預(yù)測,細胞核內(nèi)的PD-L1可能參與DNA損傷修復(fù)通路�����,從而調(diào)控DNA損傷修復(fù)和對化療的耐藥性��,不過潛在作用機制仍然需要實驗澄清�。
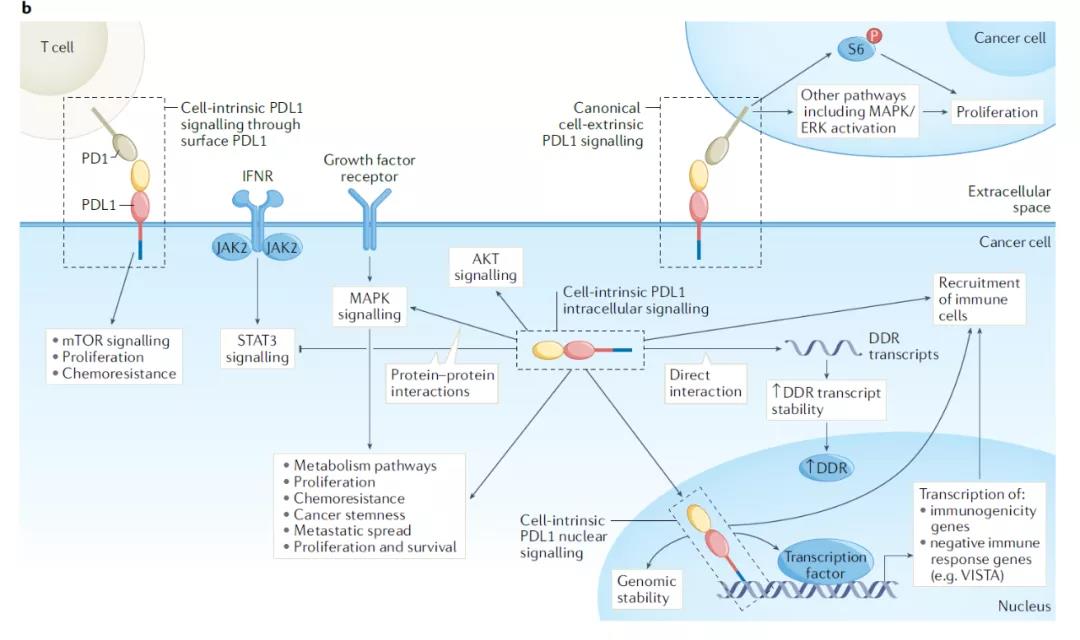
▲PD-L1影響多種癌細胞內(nèi)的信號通路(圖片來源:參考資料[1])
癌細胞內(nèi)PD-L1介導(dǎo)信號的免疫學(xué)后果PD-L1通過與PD-1結(jié)合對免疫細胞的影響是抗癌免疫療法的基石����,這一作用機制已經(jīng)廣為人知。與之相比��,癌細胞內(nèi)PD-L1介導(dǎo)的信號通路對抗癌免疫反應(yīng)的影響卻很少受到關(guān)注���。PD-L1可以通過抑制STAT3的激活�����,在小鼠黑色素瘤細胞中抑制對IFNα和IFNβ和IFNγ的敏感性�,也可以在小鼠三陰性乳腺癌體外和體內(nèi)模型中促進細胞焦亡,從而增強腫瘤的免疫原性細胞死亡�。有趣的是,細胞核內(nèi)的PD-L1可以在不同三陰性乳腺癌細胞系中促進I型主要組織相容復(fù)合體(MHC)的表達����,理論上這可以改善抗原特異性免疫識別或抑制自然殺傷細胞。通過在人類乳腺癌和結(jié)腸癌細胞中調(diào)節(jié)DNA損傷反應(yīng)��,和/或?qū)毎|(zhì)中損傷核苷酸的感知����,PD-L1可以影響腫瘤的免疫原性。值得注意的是���,有些PD-L1介導(dǎo)的癌細胞內(nèi)信號通路�����,特別是細胞內(nèi)PD-L1介導(dǎo)的信號��,明顯不會受到抗PD-L1抗體的影響�����。這意味著���,設(shè)計新的方法來靶向癌細胞內(nèi)的PD-L1信號可能輔助抗PD-L1抗體的作用����。
綜述指出��,癌細胞內(nèi)PD-L1介導(dǎo)的信號可以在三個領(lǐng)域被應(yīng)用于臨床開發(fā):作為單藥療法或組合療法的靶點����,作為治療應(yīng)答的生物標(biāo)志物����,或作為預(yù)后生物標(biāo)志物。多個團隊已經(jīng)用實驗證明了清除腫瘤PD-L1的小分子作為抗癌療法的潛力�。比如,名為verteporfin的小分子化合物能夠降低特定人類腫瘤細胞系����、免疫和基質(zhì)細胞中的PD-L1,它可以在小鼠卵巢癌模型中改善PARP抑制劑的療效���。天然產(chǎn)物姜黃素能夠促進PD-L1的泛素化�,從而清除癌細胞中的PD-L1�。它在小鼠三陰性乳腺癌模型中改善抗CTLA-4免疫療法的療效��。一些小分子抑制劑也具有降低細胞PD-L1表達的效果�����,比如�����,EGFR抑制劑gefitinib能夠降低PD-L1的表達水平��,在動物模型中改善抗PD-1免疫療法的功效���。EGFR抑制劑erlotininb和osemertinib在人類小細胞肺癌細胞系中也有抑制腫瘤PD-L1表達的效果。綜述的作者通過挖掘藥物化合物庫發(fā)現(xiàn)了17款清除腫瘤PD-L1的候選療法�,它們平均能將PD-L1水平降低超過2.6倍。這些化合物具有改善DNA損傷反應(yīng)抑制劑療效的功能����。小分子之外,抗體���、多肽和反義寡核苷酸都可以用于降低PD-L1的表達�。值得一提的是,雖然PD-L1缺失的腫瘤可能對IFNα��、IFNβ���、IFNγ或損傷DNA的細胞毒性藥物更為敏感��,也有不少研究報告癌細胞內(nèi)的PD-L1信號介導(dǎo)對化療的耐藥性���,但是一個重要的例外是在攜帶BRAF V600E突變的結(jié)腸癌細胞中,PD-L1的表達反而提高了對化療的敏感性�����。這意味著清除細胞內(nèi)PD-L1可能對某些療法有益�,但是增加對另一些療法的耐藥性����。
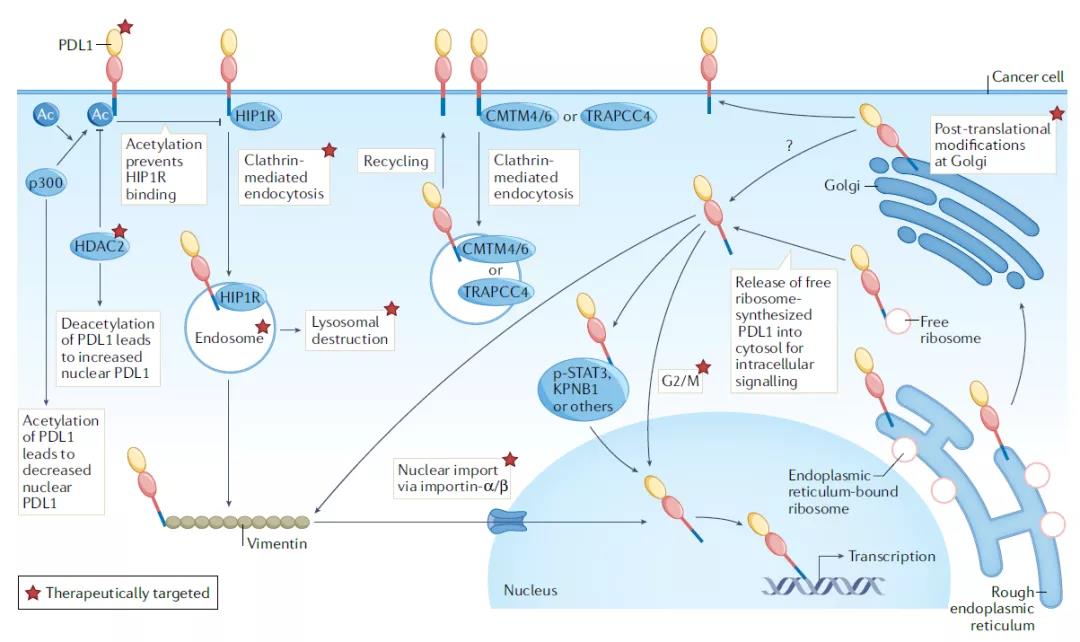
▲調(diào)控細胞內(nèi)PD-L1的機制和潛在藥物靶點(圖片來源:參考資料[1])
在細胞內(nèi)不同亞細胞區(qū)域PD-L1的功能有所不同,因此�,清除特定亞細胞區(qū)域的PD-L1可能比全面清除PD-L1獲得更好的效果。比如�����,肺癌轉(zhuǎn)移瘤中細胞核內(nèi)的PD-L1水平比原位瘤更高,如果核內(nèi)PD-L1導(dǎo)致肺癌轉(zhuǎn)移瘤的免疫檢查點抑制劑耐藥性的話�,清除核內(nèi)PD-L1的藥物可能提高免疫檢查點抑制劑的療效。在結(jié)腸癌細胞系中����,一款靶向HDAC2的小分子抑制劑能夠降低腫瘤細胞核內(nèi)PD-L1的積累,實驗表明它能夠改善抗PD-1免疫療法的效果�。
綜述作者指出,PD-L1產(chǎn)生的癌細胞內(nèi)信號可以影響生長�����、生存��、轉(zhuǎn)移�����、代謝����、分化、干細胞特征和療法耐藥通路�。這些通路雖然錯綜復(fù)雜,但是也提供了潛在可操作的創(chuàng)新靶點���。它們可能帶來更為有效的療法��,或者改善已有療法的療效�。目前,為晚期癌癥患者開發(fā)創(chuàng)新免疫療法和理性設(shè)計組合療法來改善患者預(yù)后受到人們的廣泛關(guān)注���,作者預(yù)計靶向癌細胞內(nèi)PD-L1信號將在這一領(lǐng)域大有作為��。
參考資料:
[1] Kornepati et al., (2022). Programmed death ligand 1 signals in cancer cells. Nature Reviews Cancer, https://doi.org/10.1038/s41568-021-00431-4
文章來源:藥明康德





