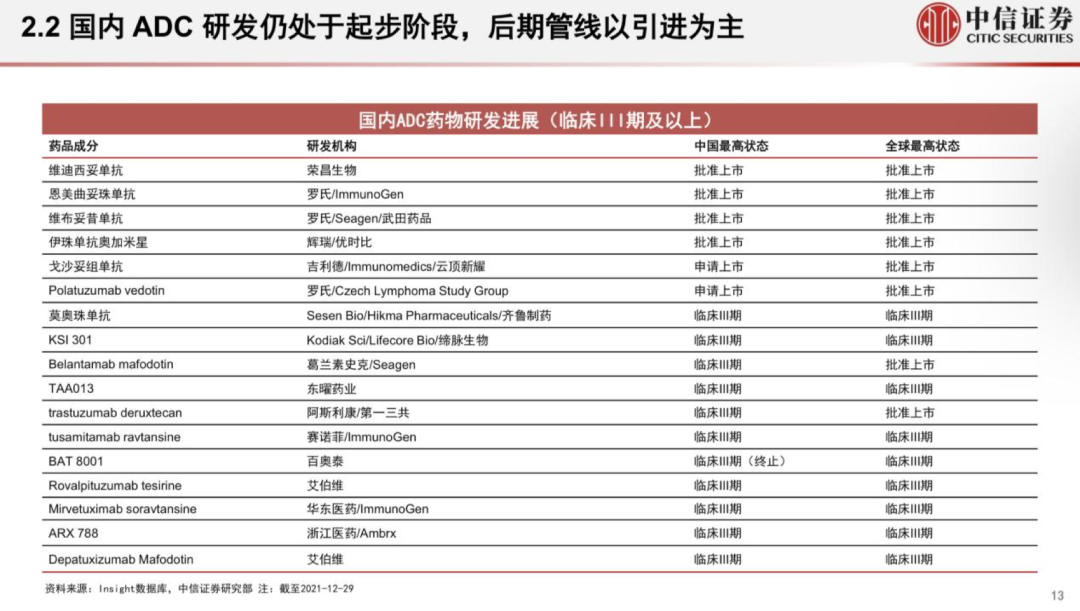
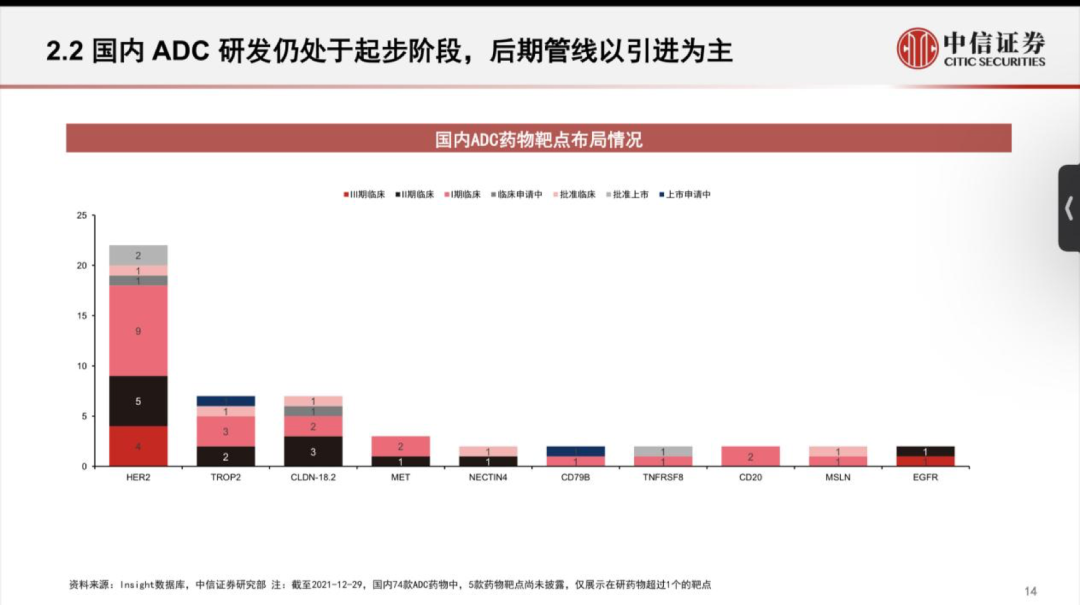
國內(nèi)ADC新貴樂普生物成功登陸港交所���;華東醫(yī)藥9.3億美元大手筆引進(jìn)4款A(yù)DC新藥;天士力與Sutro Biopharma關(guān)于ADC藥物合作或?qū)⒅匦掠懻?。近來,熱度居高不下的國?nèi)ADC藥物市場近來頗為活躍����。如今國內(nèi)的ADC賽道��,傳統(tǒng)大藥企與biotech新貴站在同場競技的舞臺���。ADC藥物領(lǐng)頭羊榮昌生物已有7條ADC產(chǎn)品管線,多禧生物則布局了多達(dá)17條產(chǎn)品管線���。國內(nèi)大藥企中���,恒瑞、華東也已經(jīng)紛紛上陣���,通過自研或引進(jìn)����,布局自身的ADC產(chǎn)品管線�。 放眼全球,國際巨頭也正在大力布局這一賽道����,吉利德210億美元收購Immunomedics,第一三共與阿斯利康達(dá)成120億美元的合作�����,衛(wèi)材與BMS達(dá)成31億美元共同開發(fā)協(xié)議,強(qiáng)生和禮來也分別投入超10億美元入局ADC賽道��。距離2000年后才上市的首款A(yù)DC產(chǎn)品不過20年的時(shí)間�,如今這一賽道已經(jīng)身處“舊靶點(diǎn)同質(zhì)化,新靶點(diǎn)風(fēng)險(xiǎn)大”的時(shí)代�。01 僅3款進(jìn)臨床,F(xiàn)Rα靶點(diǎn)嶄露頭角 在日前發(fā)布的Sutro Biopharma公司年報(bào)中顯示���,其與天士力的ADC藥物合作或?qū)⒈惶焓苛χ匦驴紤]。距離兩家公司“官宣”合作僅3個(gè)月有余���,為何突然現(xiàn)在傳出可能終止的情況�? 圖丨Sutro Biopharma公司年報(bào)去年12月24日����,天士力宣布獲得Sutro Biopharma公司靶向葉酸受體α(FRα)的抗體偶聯(lián)藥物 STRO-002 在中國大陸及港澳臺的獨(dú)家開發(fā)和商業(yè)化權(quán)益,交易金額包括 4000 萬美元首付款和潛在最高 3.45 億美元的開發(fā)及商業(yè)化里程碑付款��,以及約定比例的銷售提成����。已擁有16條生物藥管線的天士力�����,引進(jìn)STRO-002進(jìn)軍ADC市場����,也被業(yè)內(nèi)看作拓寬腫瘤治療藥物產(chǎn)品管線��、提升產(chǎn)品組合的重要舉措�。FRα在腫瘤中的高度表達(dá)讓其成為一個(gè)新的備受關(guān)注的靶點(diǎn)。FRα具有腫瘤細(xì)胞特異性�����,在卵巢癌��、子宮內(nèi)膜癌�、乳腺癌和非小細(xì)胞肺癌等腫瘤組織中高表達(dá),在正常組織中不表達(dá)或者表達(dá)量非常低�����。有研究顯示���,F(xiàn)Rα在76%-89%的上皮卵巢癌中高度表達(dá)�����,在35%-68%的三陰性乳腺癌中高度表達(dá)��。因此靶向FRα有望特異性治療包括卵巢癌�、非小細(xì)胞肺癌(NSCLC)、乳腺癌和子宮內(nèi)膜癌等多種實(shí)體瘤�����。天士力所布局的FRα靶點(diǎn)��,當(dāng)前在全球范圍內(nèi)尚無藥物獲批上市���。從處于臨床階段的項(xiàng)目數(shù)量來看,布局于此的產(chǎn)品相較HER2等熱門靶點(diǎn)而言較少���。處于臨床階段的藥物僅有三款����,包括ImmunoGen公司的IMGN853����、衛(wèi)材公司的MORAb-202與Sutro Biopharma公司的STRO-002��。因此不難解釋天士力斥資近4億美元選擇這款藥物的原因���,可以通過避免同質(zhì)化競爭,進(jìn)而實(shí)現(xiàn)產(chǎn)品的差異化發(fā)展����。從臨床試驗(yàn)進(jìn)度來看,ImmunoGen公司處于臨床III期的IMGN853有望成為該靶點(diǎn)首個(gè)獲批的ADC產(chǎn)品��。IMGN853是全球首個(gè)針對FRα陽性卵巢癌的ADC候選藥��,擬開發(fā)用于葉酸受體α高表達(dá)�����、且對鉑耐藥的卵巢癌患者���,屬于全球首創(chuàng)產(chǎn)品���。IMGN853是目前靶向FRα藥物中進(jìn)展最快的,ImmunoGen公司此前預(yù)計(jì)2022年第一季度在美國遞交IMGN853 的生物制品許可申請(BLA)�。 早在2020年10月�����,華東醫(yī)藥全資子公司杭州中美華東制藥有限公司便與ImmunoGen達(dá)成協(xié)議�����,獲得IMGN853在大中華區(qū)的獨(dú)家臨床開發(fā)及商業(yè)化權(quán)益���。交易總金額超過3億美元。去年3月31日��,華東制藥申報(bào)的IMGN853已獲得國內(nèi)臨床默示許可��,適應(yīng)癥為葉酸受體α高表達(dá)的鉑類耐藥的晚期高級別上皮性卵巢癌���、原發(fā)性腹膜癌或輸卵管癌患者�����。 而另一款來自衛(wèi)材和BMS合作開發(fā)的MORAb-202,有望摘下“Best-in-class”桂冠����。MORAb-202是衛(wèi)材開發(fā)的首個(gè)ADC產(chǎn)品,由衛(wèi)材研發(fā)的FRα抗體farletuzumab和抗癌藥eribulin組成,具有良好的藥理學(xué)特征�,并在晚期實(shí)體瘤患者中表現(xiàn)出單藥活性。在去年6月���,衛(wèi)材和BMS就MORAb-202的共同開發(fā)和商業(yè)化達(dá)成了獨(dú)家全球戰(zhàn)略合作協(xié)議���。根據(jù)協(xié)議,衛(wèi)材和BMS將在亞太國家(包括日本����、中國)、美國���、加拿大��、歐洲(包括歐盟和英國)和俄羅斯共同開發(fā)和商業(yè)化MORAb-202����。BMS將全權(quán)負(fù)責(zé)在合作區(qū)域以外開發(fā)和商業(yè)化該藥物���。衛(wèi)材則繼續(xù)負(fù)責(zé)全球的生產(chǎn)和供應(yīng)��,該筆交易的總額高達(dá)31億美元����。 MORAb-202目前正在日本開展I期臨床試驗(yàn)、并在美國進(jìn)行I/II期臨床試驗(yàn)�,用以評估MORAb-202靶向治療FRα陽性實(shí)體瘤(包括子宮內(nèi)膜癌、卵巢癌�、肺癌和乳腺癌)的效果。 STRO-002同樣是“Best-in-class”的有力競爭者�����。目前正在歐美開展針對復(fù)發(fā)卵巢癌和子宮內(nèi)膜癌的I期臨床研究�����,其中復(fù)發(fā)卵巢癌劑量爬坡研究已于2020年8月完成���。在2021年的ASCO會議中��,Sutro公布了相關(guān)臨床數(shù)據(jù)�,數(shù)據(jù)顯示����,STRO-002針對多線治療后復(fù)發(fā)的鉑耐藥/復(fù)發(fā)卵巢癌具有積極的初步療效,且安全耐受性良好����。基于此數(shù)據(jù)�����,Sutro擬與FDA溝通以II期單臂研究作為注冊臨床申請加速審批上市�����。此外���,Sutro還計(jì)劃在美國啟動一項(xiàng)STRO-002與貝伐珠單抗聯(lián)用治療復(fù)發(fā)卵巢癌的臨床研究����。同時(shí)�����,STRO-002也有潛力擴(kuò)展到其他腫瘤適應(yīng)癥如葉酸受體α表達(dá)陽性的三陰性乳腺癌和NSCLC等�����,Sutro表示�����,針對NSCLC的臨床前研究也正在進(jìn)行中。值得注意的是����,與另外兩款靶向FRα的ADC產(chǎn)品的最大差異是,STRO-002是目前唯一一款處于臨床試驗(yàn)階段����、不區(qū)分患者FRα表達(dá)水平的產(chǎn)品,因此��,業(yè)內(nèi)認(rèn)為有望成為“best-in-class”產(chǎn)品��。讓人感到意外的是����,Sutro Biopharma在其年報(bào)中披露,天士力已于今年2月表明將重新討論與Sutro關(guān)于FRα ADC新藥STRO-002的合作���,Sutro稱天士力有權(quán)在適當(dāng)?shù)臅r(shí)侯或者因?yàn)檫m當(dāng)?shù)脑蚪K止合作�����。從消息面上來看����,不論是Sutro 還是天士力,都沒有向外界透露可能重新討論合作的原因�。但分析人士認(rèn)為���,這可能與Sutro最新公布的STRO-002的I期臨床數(shù)據(jù)中透露出的安全性問題有關(guān)�。最新數(shù)據(jù)顯示��,雖然安全性方面并沒有出現(xiàn)新的副作用信號����,但有1例中性粒細(xì)胞減少癥引起的死亡。為此����,Sutro調(diào)整了試驗(yàn)方案,出現(xiàn)4級中性粒細(xì)胞減少時(shí)采取必要的劑量減少�。的確,ADC藥物的劑量策略一直是監(jiān)管機(jī)構(gòu)關(guān)注的重點(diǎn)之一����。今年2月,F(xiàn)DA曾發(fā)布了一份ADC監(jiān)管指南草案���,其中提到�����,由于ADC分子本身由抗體和細(xì)胞毒性藥物組成�,最優(yōu)的劑量策略需要考慮到抗體藥物和載荷藥物在藥代動力學(xué)和藥效學(xué)上的區(qū)別。雖然ADC技術(shù)不斷螺旋上升�����,逐漸演化到第三代�,已經(jīng)展現(xiàn)出了良好的穩(wěn)定性和藥代動力學(xué),在提高療效的同時(shí)�,毒性反應(yīng)明顯降低。但是����,ADC產(chǎn)品仍面臨著毒性問題,對于藥物而言����,通過開發(fā)新的靶點(diǎn)或進(jìn)一步充分利用已驗(yàn)證靶點(diǎn)給患者帶來有效安全的ADC藥物治療方案成為首當(dāng)其沖的挑戰(zhàn)之一。 或許��,對于ADC藥物安全性的考量,是影響天士力與Sutro Biopharma未來合作的不確定因素���。02 同質(zhì)化�����、商業(yè)化競爭����,ADC已陷入激戰(zhàn)ADC藥物猶如帶刺的玫瑰���,雖然已上市的不少產(chǎn)品因擁有“誘人”的療效不斷刷新已有的標(biāo)準(zhǔn)療法,但作為一類全新的分子類型����,不僅是產(chǎn)品的毒性和副作用問題引人關(guān)注,但是在同質(zhì)化靶點(diǎn)與商業(yè)化競爭的壓力�����,讓一眾ADC研發(fā)企業(yè)扎心�����。如國內(nèi)首款自主研發(fā)上市的ADC產(chǎn)品維迪西妥單抗(RC48),盡管有望獲得西雅圖基因最高可達(dá) 24 億美元的里程碑付款���,但是其要面對的商業(yè)化競爭壓力并不輕松�。如僅針對胃癌適應(yīng)癥上����,截至 2021 年 7 月 31 日,已有多款用于胃癌治療的創(chuàng)新生物藥在美國獲批�����, 而中國僅維迪西妥單抗�、曲妥珠單抗及納武利尤單抗三款生物藥實(shí)現(xiàn)商業(yè)化,還有7 款靶向 HER2 的創(chuàng)新生物藥處于臨床試驗(yàn)階段�。有數(shù)據(jù)預(yù)測,維迪西妥單抗2022年預(yù)計(jì)銷售額為4億元�。根據(jù)當(dāng)前已經(jīng)披露的ADC產(chǎn)品的銷售額來看,他們距離成為超級重磅炸彈仍有較大的距離��。當(dāng)前僅有兩款A(yù)DC產(chǎn)品銷售額超過了10億美元��,多款產(chǎn)品的銷售業(yè)績?nèi)圆蛔?億美元���。被稱為是全球商業(yè)化最成功的ADC藥物�,羅氏的Kadcyla,其2021年銷售額增長16%�,達(dá)到19.82億瑞士法郎。但是它能否繼續(xù)保持這樣的高增長仍充滿變數(shù)���,在2022年該產(chǎn)品將面臨ADC產(chǎn)品新秀Enhertu在二線乳腺癌適應(yīng)癥上的競爭���。Kadcyla于2013年獲FDA批準(zhǔn)上市,為全球首款用于治療實(shí)體瘤的ADC產(chǎn)品�����。這是羅氏繼赫賽汀(曲妥珠單抗)和帕捷特(帕妥珠單抗)之后推出的第三款HER2產(chǎn)品���。在療效上,Kadcyla對比化療延長患者無進(jìn)展生存期9.6個(gè)月���,NCCN指南將其列為HER2陽性乳腺癌二線治療首選方案�����。 來自西雅圖基因的Adcetris (維布妥昔單抗)��,是靶向CD30的ADC藥物�。該產(chǎn)品自2011年上市后,圍繞治療經(jīng)典霍奇金淋巴瘤(cHL)和系統(tǒng)性間變性大細(xì)胞淋巴瘤(sALCL)已經(jīng)獲批了6個(gè)適應(yīng)癥 �。2020年,Adcetris銷售額達(dá)到12.14億美元����,2021年銷售額達(dá)13.06億美元Clarivate預(yù)測,Adcetris的全球銷售額在2024年將突破20億美元�����。與前兩個(gè)先行者的銷售情況不同���,Enhertu勢頭相當(dāng)兇猛���。該產(chǎn)品僅上市一年,在2020年的銷售額就達(dá)9600萬美元�����,2021年該產(chǎn)品就攬獲了4.26億美元(日本以外市場)�����,同比增長123%�����,成為阿斯利康的新增長極。Enhertu彌補(bǔ)HER2陽性患者三線標(biāo)準(zhǔn)治療空白�����,對HER2+乳腺癌伴腦轉(zhuǎn)移患者同樣有效�。該產(chǎn)品是公認(rèn)療效最強(qiáng)的HER2 ADC,但是其引發(fā)肺間質(zhì)肺炎副作用的比例仍然很高�����。Enhertu可謂是已上市ADC藥物中研發(fā)管線布局最廣的藥物��,在乳腺癌���、胃癌����、結(jié)腸癌���、肺癌等多個(gè)領(lǐng)域都展現(xiàn)出顯著的治療潛力,被稱為抗癌“神藥”�����。目前,Enhertu用于HER2陽性不可切除或轉(zhuǎn)移性乳腺癌三線及以上; HER2突變的胃或胃食管交界腺癌二線治療已經(jīng)獲得FDA批準(zhǔn)�����?!蹲匀弧冯s志預(yù)測,該產(chǎn)品預(yù)計(jì)到2026年��,將以62億美元的銷售額成為最暢銷的ADC藥物��。第一三共與阿斯利康對ADC產(chǎn)品的研發(fā)充滿熱情和信心���,已經(jīng)開啟了ADC藥物之間的對決���。在2021年8月,第一三共與伙伴阿斯利康����,宣布其全球頭對頭III期臨床試驗(yàn)DESTINY-Breast 03中獲得了陽性結(jié)果。這是抗HER2的ADC藥物間的第一次對決�����,讓T-DXd一舉成為HER2陽性晚期乳腺癌二線治療的新標(biāo)準(zhǔn)。作為新一代ADC藥物最重磅的明星產(chǎn)品����,二線治療標(biāo)準(zhǔn)并不是T-DXd的終點(diǎn)。第一三共希望通過一系列在乳腺癌領(lǐng)域的臨床研究���,全面確立T-DXd 在HER2 陽性乳腺癌治療的王者地位�。 例如��,通過DESTINY-Breast 09研究向一線HER2陽性轉(zhuǎn)移性乳腺癌標(biāo)準(zhǔn)治療發(fā)起挑戰(zhàn)�;DESTINY-Breast 05 和11 二個(gè)研究則分別對照HER2陽性早期乳腺癌輔助及新輔助的標(biāo)準(zhǔn)治療。同時(shí)���,第一三共�,也對TROP2的ADC Dato-DXd充滿信心��,希望將其打造成HER2靶點(diǎn)外乳腺癌的首選ADC藥物���。對于ADC產(chǎn)品的未來����,《自然》曾預(yù)測��,2020年前上市的10款A(yù)DC藥物���,2026年將在全球創(chuàng)造出超過164億美元的市場����。但是當(dāng)商業(yè)化的理想照到現(xiàn)實(shí)��,截至2021年末���,全球已經(jīng)上市的14款A(yù)DC藥物中��,僅有兩款A(yù)DC產(chǎn)品銷售額超過了10億美元��,多款產(chǎn)品的銷售業(yè)績?nèi)圆蛔?億美元�����。其中被稱為商業(yè)化最成功的產(chǎn)品2021年銷售額為21億美元�,而該產(chǎn)品已經(jīng)上市近10年��。創(chuàng)新藥企和國內(nèi)大藥企似乎站到了同一起跑線上。無論是大藥企恒瑞���、石藥���,還是科倫、華東����,均已有布局,創(chuàng)新藥企也在這一賽道上耕耘了頗多時(shí)日���。從創(chuàng)新藥企陣營來看����,以榮昌生物生物為領(lǐng)頭羊�,樂普生物、多禧生物�、科倫博泰均表現(xiàn)不凡。榮昌生物的產(chǎn)品管線中����,擁有7款A(yù)DC產(chǎn)品,靶點(diǎn)分布在HER2�����、間皮素�����、c-MET���、Claudin 18.2等���,其中RC48已上市。樂普生物產(chǎn)品管線中��,已有5款A(yù)DC產(chǎn)品��,且已經(jīng)進(jìn)入臨床階段��。樂普生物成立于2018年���,一舉收購ADC大戶美雅珂�,成為國內(nèi)ADC行業(yè)的佼佼者��,已有5條ADC產(chǎn)品管線����。而科倫子公司��,科倫博泰主要聚焦于ADC藥物的研發(fā)�����,目前已披露的ADC 產(chǎn)品有3款�����,均為第三代ADC藥物����。值得關(guān)注的是�,這家成立于2012年的多禧生物,也有望在激烈的ADC競爭中突圍���。多禧生物��,是專門針對于ADC藥物研發(fā)的biotech公司����,該公司聚焦獨(dú)立技術(shù)平臺和開發(fā)新靶點(diǎn)能力這兩大藥物上市的突圍“殺器”�。公開信息顯示��,多禧生物擁有不同階段的17條產(chǎn)品管線���,具備自主知識產(chǎn)權(quán)的連接子、毒性分子����、抗體工程技術(shù)平臺���,聚焦腫瘤領(lǐng)域���,開發(fā)了Her2、Trop2�����、MUC1等靶點(diǎn)的創(chuàng)新ADC藥物��。2021年4月其MUC1 ADC藥物的臨床試驗(yàn)申請獲得NMPA受理�,是首個(gè)國產(chǎn)MUC1 ADC。至2021年12月����,多禧生物已有4款A(yù)DC藥物獲批臨床��,并且該公司在2021年完成了10億元C輪融資���。2019年多禧生物與君實(shí)生物達(dá)成合作,在授權(quán)許可區(qū)域內(nèi)負(fù)責(zé) TROP2 靶向的DAC-002 后續(xù)的研發(fā)�����、注冊���、生產(chǎn)�、銷售及其他商業(yè)活動�。2020年9月,該產(chǎn)品啟動I期臨床試驗(yàn)�����,招募153例晚期實(shí)體瘤患者��。 大藥企中����,恒瑞與華東醫(yī)藥在ADC領(lǐng)域的布局相當(dāng)積極。恒瑞已有7款藥物處于不同研發(fā)階段����。其靶向HER2的SHR-A1811進(jìn)度最快�����,已進(jìn)入II期臨床;此外��,6款藥物處于臨床I期 ��,包括SHR-A1201(Kadcyla類似物)���、SHR-A1403(靶向MET)���。華東醫(yī)藥則在上周末���,剛剛完成一次大手筆的交易。華東醫(yī)藥與德國Heidelberg Pharma公司達(dá)成合作協(xié)議�,華東醫(yī)藥獲得Heidelberg Pharma4款A(yù)DC新藥的亞洲權(quán)益(除日本外),協(xié)議總金額高達(dá)9.3億美元�����。從已公開信息來看����,華東醫(yī)藥此次引進(jìn)的分別為Heidelberg Pharma研發(fā)管線中的HDP-101��、HDP-102�、HDP-103和HDP-104��,以及另外2款待選擇的新藥���。具體來看����,HDP-101靶向BCMA��,用于治療多發(fā)性骨髓瘤����;HDP-102靶向CD37,用于治療非霍奇金淋巴瘤����;HDP-103靶向PSMA,用于治療前列腺癌�。這也是繼引進(jìn)FRα靶點(diǎn)新藥IMGN853后,華東醫(yī)藥在ADC領(lǐng)域的又一布局����。授權(quán)引進(jìn)確實(shí)是當(dāng)前國內(nèi)ADC藥物賽道主要的方式���。從研究進(jìn)度上來看,國內(nèi)處于臨床后期(臨床III期及以上)的產(chǎn)品�����,幾乎都以引進(jìn)為主���。中信證劵報(bào)告顯示��,截至 2021 年 12 月 29 日��,國內(nèi)共有 74 個(gè) ADC 藥物處于不同研 發(fā)階段。其中臨床I期占比最高(為35%)����,處于臨床后期(III期及以上)的產(chǎn)品共有17款,其中本土企業(yè)申報(bào)的產(chǎn)品僅3款���,該部分藥物主要由海外藥企開發(fā)����,多是海外已經(jīng)上市或進(jìn)入臨床后期的產(chǎn)品。例如吉利德與云鼎新耀的戈沙妥組單抗�����,在國內(nèi)處于申請上市階段�����,齊魯制藥引進(jìn)的KSI301���,華東醫(yī)藥引進(jìn)自ImmunoGen的產(chǎn)品��,浙江醫(yī)藥引進(jìn)自Ambrx的相關(guān)ADC產(chǎn)品均處于臨床三期階段���。除榮昌生物、東曜藥業(yè)��、百奧泰(已終止)的3款藥物為自主研發(fā)外�����,其余均由外企研發(fā)����。注:本文部分相關(guān)內(nèi)容參考自中信證券《群雄紛爭����,ADC藥物領(lǐng)域快速發(fā)展》
文章來源:E藥經(jīng)理人