2022年3月7日,Horizon Therapeutics宣布�����,美國FDA授予Krystexxa的補充生物制品許可申請(sBLA)優(yōu)先審評資格,這一申請尋求將Krystexxa與甲氨蝶呤聯(lián)用��,治療痛風(fēng)無法控制的患者�。Krystexxa(中文名普瑞凱希,通用名pegloticase)是一款治療痛風(fēng)的藥物����,于2010年獲FDA批準用于治療常規(guī)治療無效或常規(guī)治療無法耐受的成人慢性痛風(fēng)患者。甲氨蝶呤是一種通常治療風(fēng)濕病的免疫調(diào)節(jié)劑��。
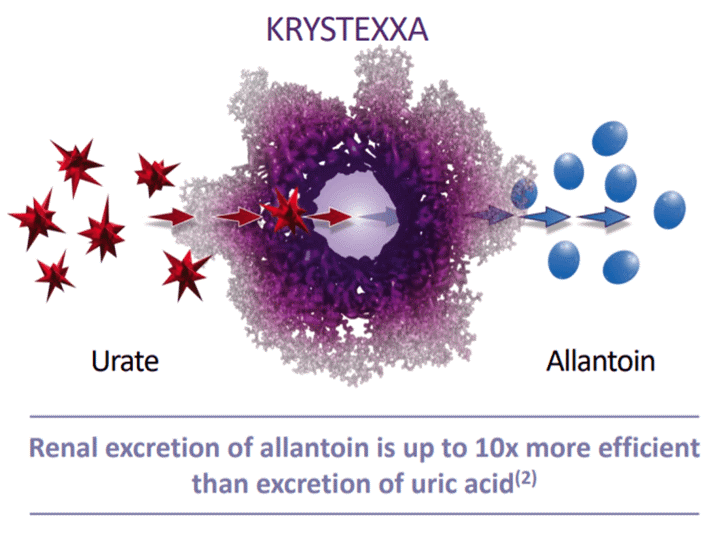
Krystexxa是一款獲批治療無法控制的痛風(fēng)(Uncontrolled Gout)的生物制品�����。Krystexxa通過大幅降低疾病的身體負擔(dān)���,改變患者的治療過程��。Krystexxa能將尿酸轉(zhuǎn)化為尿囊素��,尿囊素是一種水溶性分子����,可通過尿液輕松排出體外,其腎臟排泄效率是尿酸的10倍�。但是,部分接受Krystexxa治療的患者出現(xiàn)針對藥物的抗體�,限制了治療的有效性。而最新數(shù)據(jù)表明����,Krystexxa聯(lián)合甲氨蝶呤有助于防止產(chǎn)生這些抗體,幫助更多的患者獲得持久的治療反應(yīng)�。
本次申請遞交是基于一項隨機對照試驗獲得的積極結(jié)果。該試驗中�����,152例患有無法控制的痛風(fēng)的患者隨機接受甲氨蝶呤或安慰劑治療4周����,然后接受Krystexxa+甲氨蝶呤、或Krystexxa+安慰劑治療52周�。主要終點為血清尿酸(sUA)完全應(yīng)答者比例���,定義為6個月中至少80%的時間sUA<6 mg/dL����。試驗結(jié)果顯示,71%(n=71/100)接受Krystexxa+甲氨蝶呤治療的患者����,和40%(n=21/52)隨機接受Krystexxa+安慰劑的患者達到了主要終點(p<0.001)。安全性上���,未發(fā)現(xiàn)新的安全性問題�。這些結(jié)果顯示聯(lián)合使用甲氨蝶呤改善了Krystexxa的治療應(yīng)答率����。“患有不受控制的痛風(fēng)的患者面臨著(疾病)對他們?nèi)粘I畹闹卮笥绊?,以及較高的并發(fā)癥風(fēng)險,強調(diào)了迫切需要降低這一群體尿酸鹽負擔(dān)的療法���?����!盚orizon公司董事長���、總裁兼首席執(zhí)行官Tim Walbert先生表示�,“Horizon大力投入臨床研究����,以提高Krystexxa的療效,幫助確保更多患者能夠從療法中獲益��。我們?nèi)匀恢铝τ趲椭l(fā)展不受控制的痛風(fēng)的標準治療�。”
參考資料:
[1] Horizon Therapeutics plc Announces FDA Has Granted Priority Review of the Supplemental Biologics License Application (sBLA) for the Concomitant Use of Krystexxa? (pegloticase injection) Plus Methotrexate for People Living With Uncontrolled Gout. Retrieved March 7, 2022, from https://www.businesswire.com/news/home/20220307005264/en/Horizon-Therapeutics-plc-Announces-FDA-Has-Granted-Priority-Review-of-the-Supplemental-Biologics-License-Application-sBLA-for-the-Concomitant-Use-of-Krystexxa%C2%AE-pegloticase-injection-Plus-Methotrexate-for-People-Living-With-Uncontrolled-Gout
[2] MIRROR Randomized Controlled Trial Meets Primary Endpoint and Shows 71% of Patients Achieved a Complete Response Rate Using KRYSTEXXA? (pegloticase injection) with Methotrexate. Retrieved October 25, 2021, from https://ir.horizontherapeutics.com/news-releases/news-release-details/mirror-randomized-controlled-trial-meets-primary-endpoint-and



